名校
解题方法
1 . 化学电源在生产生活中有着广泛的应用,请回答下列问颕:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: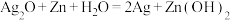 。
。
①工作时电流从___________ 极流向___________ 极(两空均选填“ ”或“Zn”);
”或“Zn”);
②负极的电极反应式为:___________ ;
③工作时电池正极区的pH___________ (选填“增大”“减小”或“不变”);
④外电路中每通过0.2mol电子,锌的质量理论上减少___________ g。
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“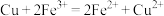 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是___________ (填化学式),电解质溶液是___________ (填化学式)溶液。
②正极上发生的电极反应为___________ 。
③若导线上转移的电子为1mol,则消耗的金属铜的质量为___________ 。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
A.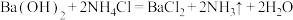 |
B. |
C. |
D. |
 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: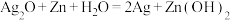 。
。①工作时电流从
 ”或“Zn”);
”或“Zn”);②负极的电极反应式为:
③工作时电池正极区的pH
④外电路中每通过0.2mol电子,锌的质量理论上减少
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
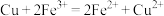 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:①该电池的负极材料是
②正极上发生的电极反应为
③若导线上转移的电子为1mol,则消耗的金属铜的质量为
您最近一年使用:0次
解题方法
2 . 到目前为止,由化学能转变的热能或电能仍然是人类使用的主要能源。
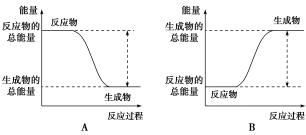
Ⅰ.从能量变化角度研究反应:2H2(g)+O2(g)=2H2O(g)。
(1)下图能正确表示该反应中能量变化的是______ (填字母)。
则生成1molH2O(g)放出热量______ kJ。
Ⅱ.某实验小组自制如图水果电池,探究影响电池效果的因素有哪些,制成记录表格如下:
回答下列问题:
(3)水果电池中,水果的作用是______ 。
(4)对比实验①②③得出的结论是______ 。
(5)欲得出“水果种类对电池效果有影响”的结论需要对比实验______ 。
Ⅲ.
(6)碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,电解质为KOH。下列说法正确的是______。
Ⅰ.从能量变化角度研究反应:2H2(g)+O2(g)=2H2O(g)。
(1)下图能正确表示该反应中能量变化的是
| 化学键 | H—H | O=O | H—O |
| 键能(kJ/mol) | 436 | 496 | 463 |
Ⅱ.某实验小组自制如图水果电池,探究影响电池效果的因素有哪些,制成记录表格如下:

| 序号 | 电极 | 电极间距(cm) | 水果种类 | 电流表(μA) |
| ① | Cu—Al | 2.0 | 西红柿 | 78.8 |
| ② | Cu—Fe | 2.0 | 西红柿 | 70.3 |
| ③ | Al—Al | 2.0 | 西红柿 | 0 |
| ④ | Cu—Al | 2.0 | 柠檬 | 45.7 |
| ⑤ | Cu—Al | 1.0 | 柠檬 | 98.4 |
(3)水果电池中,水果的作用是
(4)对比实验①②③得出的结论是
(5)欲得出“水果种类对电池效果有影响”的结论需要对比实验
Ⅲ.
(6)碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,电解质为KOH。下列说法正确的是______。
| A.MnO2发生了氧化反应 |
| B.MnO(OH)中Mn元素的化合价为+3 |
| C.当反应消耗0.65gZn,有0.01mol电子发生转移 |
| D.负极反应式为:Zn-2e-+2OH-=Zn(OH)2 |
您最近一年使用:0次
解题方法
3 . 含氮、磷、砷化合物的转化和处理是环境保护的重要课题。
(1)研究团队采用NaClO氧化法去除水中氨氮( 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
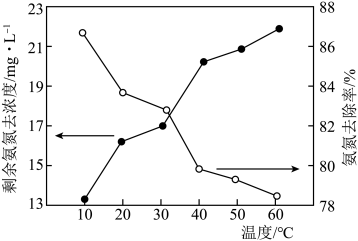
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为___________ 。
(2)十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
①向银氨溶液中加入 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为___________ 。
② 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是___________ 。
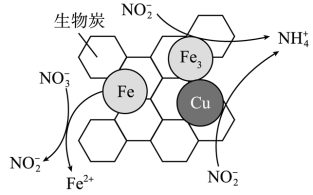
(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是___________ ; 转化为
转化为 的反应机理可描述为
的反应机理可描述为___________ 。
(1)研究团队采用NaClO氧化法去除水中氨氮(
 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
(2)十八面体结构的
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。①向银氨溶液中加入
 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为②
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是 转化为
转化为 的反应机理可描述为
的反应机理可描述为
您最近一年使用:0次
名校
解题方法
4 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
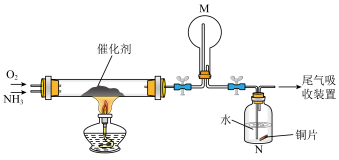
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
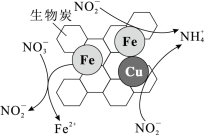
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
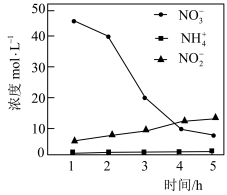
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近一年使用:0次
名校
5 . 人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,放电时金属锂作______ 极。比能量是指消耗单位质量的电极所释放的电量,可用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为______ 。
②一种制备CuO的过程如图:
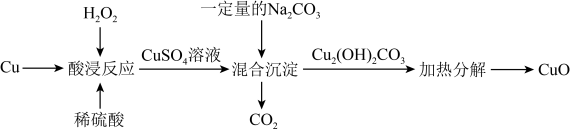
写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式:______ 。
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。
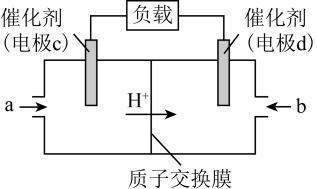
物质a为______ (填化学式):电极c上发生的电极反应方程式为______ 。
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li-CuO二次电池的比能量高、工作温度宽。Li-CuO二次电池中,放电时金属锂作
②一种制备CuO的过程如图:

写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式:
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

物质a为
您最近一年使用:0次
22-23高一下·全国·期中
解题方法
6 . 能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_______ (填标号)。
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
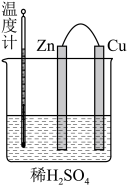
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是_______(填标号)。

(3)图Ⅱ中外电路中的电子是从_______ (填“Zn”或“Cu”)电极经导线流向_______ 电极。若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为_______ 。若电池的总反应为2Fe3++Cu=2Fe2++Cu2+,则负极材料是_______ (填化学式)。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2CO(g)+O2(g)=2CO2(g)
(2)为了探究化学反应中的能量变化,某同学设计了如图所示两个实验。有关实验现象,下列说法正确的是_______(填标号)。

| A.图Ⅰ和图Ⅱ的气泡均产生于锌棒表面 |
| B.图Ⅱ中产生气体的速率比图Ⅰ快 |
| C.图Ⅰ中温度计的示数高于图Ⅱ的示数 |
| D.图Ⅰ和图Ⅱ中温度计的示数相等,且均高于室温 |
您最近一年使用:0次
解题方法
7 . 原电池是直接把化学能转化为电能的装置。
(1)如图所示:
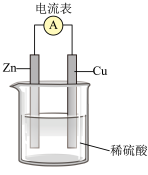
①在Cu-Zn原电池中,Zn片上发生___________ 反应(填“氧化”或“还原”)。 Cu片上发生的电极反应式为___________ 。
②外电路中电子流向___________ 极(填 “正”或“负”,下同); 内电路溶液中SO 移向
移向___________ 极。
(2)某原电池的总反应为Zn + Cu2+ = Cu + Zn2+,该原电池组成正确的是___________。
(3)某锂-空气电池的总反应为4Li + O2 + 2H2O = 4LiOH,其工作原理如图所示:
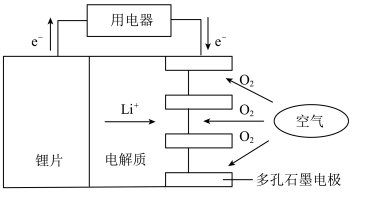
下列说法正确的是___________ 。
a.锂片作负极
b.O2发生氧化反应
c.正极的反应式为 O2 + 4e-+ 2H2O = 4OH-
(1)如图所示:

①在Cu-Zn原电池中,Zn片上发生
②外电路中电子流向
 移向
移向(2)某原电池的总反应为Zn + Cu2+ = Cu + Zn2+,该原电池组成正确的是___________。
A.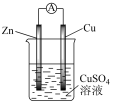 | B.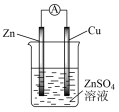 |
C. | D.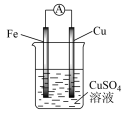 |

下列说法正确的是
a.锂片作负极
b.O2发生氧化反应
c.正极的反应式为 O2 + 4e-+ 2H2O = 4OH-
您最近一年使用:0次
名校
解题方法
8 . I.能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_____ (填序号)。
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(2)放电时负极反应为_____ 。
(3)放电时正极附近溶液的碱性_____ (填“增强”或“减弱”或“不变”)。
(4)放电时每转移_____ mol电子,正极有1molK2FeO4被还原。
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是_____ 。
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。_____ 。
(7)a膜为_____ (填“阳离子”或“阴离子”,下同)交换膜,b膜为_____ 交换膜。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
| A.CaO(s)+H2O(l)=Ca(OH)2(aq) | B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) |
| C.2CO(g)+O2(g)=2CO2(g) | D.Fe(s)+2FeCl3(aq)=3FeCl2(aq) |
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。(2)放电时负极反应为
(3)放电时正极附近溶液的碱性
(4)放电时每转移
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是
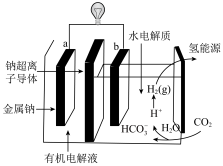
| A.Na+将从a极移动到b极 |
| B.该电池的电解液可以换成更易导电的饱和NaCl溶液 |
C.b极区可能会发生Na++HCO =NaHCO3↓ =NaHCO3↓ |
| D.b极区每生成1molH2转移2mol电子 |
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。

(7)a膜为
您最近一年使用:0次
2023-04-26更新
|
559次组卷
|
2卷引用:天津市第一中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
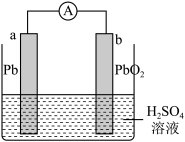
9 . 化学电源在生产、生活中有着广泛的应用。回答下列问题:
(1)图中,正极电极反应式:______ ;电子流向:______ (填“ ”或“Cu”,下同)极经导线流入
”或“Cu”,下同)极经导线流入______ 极。
(2)铅蓄电池是常见的二次电池,其工作原理如图所示。放电时总反应为 ,负极电极反应式为
,负极电极反应式为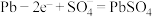 。
。
①写出放电时正极的电极反应式:______ ;
②铅蓄电池放电时一段时间,当转移 电子时,负极质量将增大
电子时,负极质量将增大______ g。
(3)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为 。
。
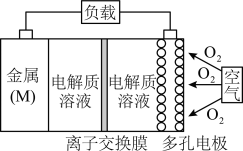
已知:①电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
②阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
比䢂Mg、Al、Zn三种金属-空气电池,则Mg、Al、Zn分别作为电极时“理论比能量”由大到小的顺序为______ ,该电池正极的电极反应式为______ ,若为 -空气电池,为防止负极区沉积
-空气电池,为防止负极区沉积 ,宜采用
,宜采用______ (填“阳离子”或“阴离子”)交换膜。
(1)图中,正极电极反应式:
 ”或“Cu”,下同)极经导线流入
”或“Cu”,下同)极经导线流入
(2)铅蓄电池是常见的二次电池,其工作原理如图所示。放电时总反应为
 ,负极电极反应式为
,负极电极反应式为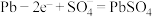 。
。
①写出放电时正极的电极反应式:
②铅蓄电池放电时一段时间,当转移
 电子时,负极质量将增大
电子时,负极质量将增大(3)金属(M)-空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为
 。
。
已知:①电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
②阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。
比䢂Mg、Al、Zn三种金属-空气电池,则Mg、Al、Zn分别作为电极时“理论比能量”由大到小的顺序为
 -空气电池,为防止负极区沉积
-空气电池,为防止负极区沉积 ,宜采用
,宜采用
您最近一年使用:0次
名校
10 . 锂锰电池反应原理如图所示,其中电解质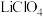 溶于混合有机溶剂中,
溶于混合有机溶剂中, 通过电解质迁移入
通过电解质迁移入 晶格中,生成
晶格中,生成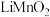 。回答下列问题:
。回答下列问题:
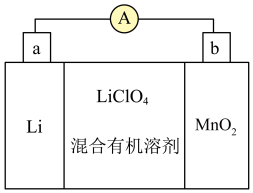
(1)锂的原子结构示意图为___________ ,锂在空气中燃烧,产物为___________ (填化学式)。
(2)该电池中作正极的是___________ (填“a”或“b”),电池负极反应式为___________ 。
(3)是否可用水代替电池中的混合有机溶剂?回答“是”或“否”,并说明理由:___________ 。
(4) 可与
可与 和
和 在高温下反应,生成
在高温下反应,生成 、
、 和
和 ,反应的化学方程式为
,反应的化学方程式为___________ 。 在酸性溶液中歧化,生成
在酸性溶液中歧化,生成 和
和 的物质的量之比为
的物质的量之比为___________ 。
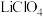 溶于混合有机溶剂中,
溶于混合有机溶剂中, 通过电解质迁移入
通过电解质迁移入 晶格中,生成
晶格中,生成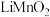 。回答下列问题:
。回答下列问题:
(1)锂的原子结构示意图为
(2)该电池中作正极的是
(3)是否可用水代替电池中的混合有机溶剂?回答“是”或“否”,并说明理由:
(4)
 可与
可与 和
和 在高温下反应,生成
在高温下反应,生成 、
、 和
和 ,反应的化学方程式为
,反应的化学方程式为 在酸性溶液中歧化,生成
在酸性溶液中歧化,生成 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次



