1 . 2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,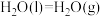
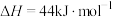 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式______ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是___________ (填字母)。
A. B.容器内压强一定 C.气体平均相对分子质量一定
B.容器内压强一定 C.气体平均相对分子质量一定
D.气体密度一定 E. 的体积分数一定
的体积分数一定
②已知容器的容积为5 L,初始加入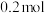
 和
和
 ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为___________ 。
③温度不变,再加入 、
、 、
、 、
、 各
各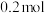 ,则
,则
___________ (填“>”“<”或“=”) 。
。
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: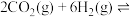
 。当
。当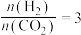 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示。
的平衡转化率随温度及压强变化如图所示。

①该反应的
___________ (填“>”或“<”)0。
②图中压强(p)由大到小的顺序是___________ 。
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。

①系统工作时,a极为___________ 极,b极区的电极反应式为___________ 。
②系统工作时b极区有少量固体析出,可能的原因是___________ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,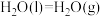
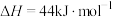 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定 C.气体平均相对分子质量一定
B.容器内压强一定 C.气体平均相对分子质量一定 D.气体密度一定 E.
 的体积分数一定
的体积分数一定②已知容器的容积为5 L,初始加入
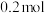
 和
和
 ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为③温度不变,再加入
 、
、 、
、 、
、 各
各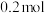 ,则
,则
 。
。(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: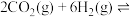
 。当
。当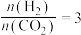 时,实验测得
时,实验测得 的平衡转化率随温度及压强变化如图所示。
的平衡转化率随温度及压强变化如图所示。
①该反应的

②图中压强(p)由大到小的顺序是
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。

①系统工作时,a极为
②系统工作时b极区有少量固体析出,可能的原因是
您最近一年使用:0次
名校
解题方法
2 . 水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中[Cr(Ⅵ)]常用还原沉淀法、微生物法等进行处理。
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
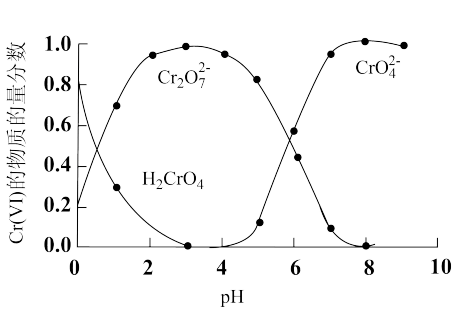
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:_______ 。[已知pH=3时,Cr(Ⅲ)以Cr3+形式存在,pH=7.5时,Cr(Ⅲ)开始沉淀]。
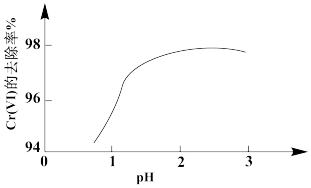
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是_______ 。
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为

您最近一年使用:0次
2022-04-19更新
|
372次组卷
|
5卷引用:江苏省2022届高三下学期3月第一次调研测试化学试题
名校
解题方法
3 . 锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为__ 。
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________ 。充电时Li+向________ (填“Se”或“Li”)极迁移。
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________ 。

(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是________ 。
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率= ×100%)分析300 ℃后,固体残留率变化的原因是
×100%)分析300 ℃后,固体残留率变化的原因是________ 。
(1) 锂硒电池具有优异的循环稳定性。
①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为
②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:
③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是

(2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S)。
① Li2S可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是
②取一定量Li2S样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=
 ×100%)分析300 ℃后,固体残留率变化的原因是
×100%)分析300 ℃后,固体残留率变化的原因是
您最近一年使用:0次
2020-05-21更新
|
868次组卷
|
6卷引用:江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题
江苏省泰州市2020届高三第二次模拟考试(5月) 化学试题江苏省扬州市江都区大桥高级中学2020届高三下学期学情调研(三)化学试题江苏省徐州市2019-2020学年高二下学期期末抽测化学试题(已下线)科技热点之几种新型电池(已下线)第18讲 原电池 化学电源(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)4.1.2 化学电源-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)
2014·上海浦东新·二模
4 . (1)在含Mg2+、Al3+、H+、Cl-的混合溶液中滴加NaOH溶液,与OH-发生反应的顺序为:___ 、___ 、Mg2+和___ 。在NaOH滴加过量后的澄清溶液中,浓度最高的离子是___ 。
(2)加热条件下,一氧化碳与硫反应可生成硫氧化碳(COS)。
①写出S原子核外最外层电子排布式___ 。
②每摩尔COS气体中含电子___ NA(阿佛加得罗常数)个。
③写出COS的电子式。___ 。
(3)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Al3+或AlO2-。为什么海水中Al元素的含量极低?___ 。
(4)某些非金属单质可与水发生置换反应,如2F2+2H2O=4HF+O2。非金属单质与水发生置换反应的另一个熟知实例是(用热化学方程式表示,热值用Q表示,Q>0):___ 。
(5)一银制摆件因日久在表面生成硫化银而变黑。使银器复原的一种方法是利用原电池原理:在一铝锅中盛盐水,将该银器浸入,并与锅底接触,放置一段时间,黑色褪去。
①构成原电池负极的材料是___ 。
②操作后可闻盐水微有臭味,估计具有臭味的物质是___ 。
(2)加热条件下,一氧化碳与硫反应可生成硫氧化碳(COS)。
①写出S原子核外最外层电子排布式
②每摩尔COS气体中含电子
③写出COS的电子式。
(3)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Al3+或AlO2-。为什么海水中Al元素的含量极低?
(4)某些非金属单质可与水发生置换反应,如2F2+2H2O=4HF+O2。非金属单质与水发生置换反应的另一个熟知实例是(用热化学方程式表示,热值用Q表示,Q>0):
(5)一银制摆件因日久在表面生成硫化银而变黑。使银器复原的一种方法是利用原电池原理:在一铝锅中盛盐水,将该银器浸入,并与锅底接触,放置一段时间,黑色褪去。
①构成原电池负极的材料是
②操作后可闻盐水微有臭味,估计具有臭味的物质是
您最近一年使用:0次
2020·山东·模拟预测
5 . 2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
| A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子 |
| B.放电时,负极反应为:LiFePO4−xe−=Li1-xFePO4+xLi+ |
| C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入 |
| D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻4.0 g |
您最近一年使用:0次
6 . 工业制硝酸的主要反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=_____ 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为_____ 。
②反应在第6min时改变了条件,改变的条件可能是_____ (填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是_____ (填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
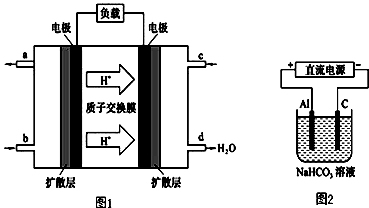
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为_____ 。
②该电池负极的电极反应式为:_____ 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:_____ (用相关的离子方程式表示)。
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2的平均反应速率为
②反应在第6min时改变了条件,改变的条件可能是
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为:
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:

您最近一年使用:0次



