解题方法
1 . 含氮、磷、砷化合物的转化和处理是环境保护的重要课题。
(1)研究团队采用NaClO氧化法去除水中氨氮( 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
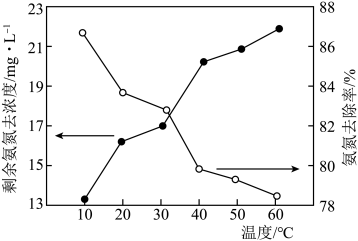
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为___________ 。
(2)十八面体结构的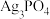 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。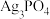 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
①向银氨溶液中加入 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到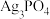 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为___________ 。
② 和
和 在溶液中反应也可制得
在溶液中反应也可制得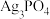 固体,但制得的
固体,但制得的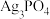 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是___________ 。
(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是___________ ; 转化为
转化为 的反应机理可描述为
的反应机理可描述为___________ 。
(1)研究团队采用NaClO氧化法去除水中氨氮(
 、
、 )。已知:HClO的氧化性比NaClO强;
)。已知:HClO的氧化性比NaClO强; 比
比 更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
更容易被氧化。在相同时间内,反应温度对剩余氨氮浓度和氨氮去除率的影响如图所示。40~60℃时氨氮去除率持续下降,其原因为
(2)十八面体结构的
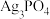 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。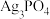 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能。①向银氨溶液中加入
 溶液,离心分离、洗涤干燥后可得到
溶液,离心分离、洗涤干燥后可得到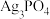 高效光催化剂,写出反应的离子方程式为
高效光催化剂,写出反应的离子方程式为②
 和
和 在溶液中反应也可制得
在溶液中反应也可制得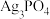 固体,但制得的
固体,但制得的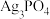 固体光催化性能极差。从速率角度解释其原因是
固体光催化性能极差。从速率角度解释其原因是(3)将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 的效率更高,其主要原因是
的效率更高,其主要原因是 转化为
转化为 的反应机理可描述为
的反应机理可描述为
您最近一年使用:0次
2 . 某小组学生研究常见的金属腐蚀现象,分析其原理.按要求回答下列问题.
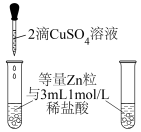
(1)甲同学设计如图所示对比实验。
当a中滴入CuSO4溶液后,观察到其中产生气泡的速率较b中的________ 。其原因是________________ 。
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。
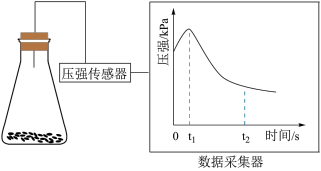
① 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为________ 。
② 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为________________ 。
③ 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为________________ 。
(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
①暖贴工作时,铁粉发生的反应为________ (填“氧化反应”或“还原反应”)。
②写出使用暖贴时的注意事项:________________ 。
③暖贴发热时,正极材料为________ ;食盐的作用为________ 。
④当暖贴放热结束时,铁粉转化成的物质中可能含有________ 。

(1)甲同学设计如图所示对比实验。
当a中滴入CuSO4溶液后,观察到其中产生气泡的速率较b中的
(2)乙同学将锥形瓶内壁用酸化的饱和食盐水润洗后,放入混合均匀的铁粉和碳粉,塞紧瓶塞,同时用压强传感器测得锥形瓶内压强的变化,如图所示。

①
 时,碳粉表面生成的气体为
时,碳粉表面生成的气体为②
 时,碳粉表面发生的电极反应式为
时,碳粉表面发生的电极反应式为③
 电化学腐蚀过程中,铁极的电极反应式为
电化学腐蚀过程中,铁极的电极反应式为(3)丙同学研读如下一次性保暖贴说明书,并分析暖贴工作原理。
| 品名:一次性保暖贴 主要成分:铁粉、水、食盐、活性炭、蛭石、吸水性树脂 产品性能:平均温度 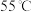 ,最高温度 ,最高温度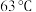 ,发热时间12小时以上 ,发热时间12小时以上 |
②写出使用暖贴时的注意事项:
③暖贴发热时,正极材料为
④当暖贴放热结束时,铁粉转化成的物质中可能含有
您最近一年使用:0次
解题方法
3 . 目前,第三代混合动力车已经投入市场,成为能源改革的典范。
(1)混合动力车一般使用镍氢电池,碱液(主要为KOH溶液)为电解质溶液。镍氢电池的充放电反应式为H2+2NiOOH 2Ni(OH)2。请写出该电池放电时正极的电极反应方程式:
2Ni(OH)2。请写出该电池放电时正极的电极反应方程式:_____ 。
(2)为实现电池的安全性,科技工作者开发出利用稀土金属氧化物作为固体电解质的氢气—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。写出该电池放电时的负极反应方程式:_____ 。
(1)混合动力车一般使用镍氢电池,碱液(主要为KOH溶液)为电解质溶液。镍氢电池的充放电反应式为H2+2NiOOH
 2Ni(OH)2。请写出该电池放电时正极的电极反应方程式:
2Ni(OH)2。请写出该电池放电时正极的电极反应方程式:(2)为实现电池的安全性,科技工作者开发出利用稀土金属氧化物作为固体电解质的氢气—空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。写出该电池放电时的负极反应方程式:
您最近一年使用:0次
名校
4 . 电化学给人类的生活和工业生产带来极大的方便。回答下列问题:
(1)一种利用垃圾渗滤液中 、
、 发电的原理如图所示。
发电的原理如图所示。

①X为该装置的_______ 极。
②写出Y极的电极反应式:_______ 。
(2)电解池在生产中有广泛的应用。
①工业上电解精炼银的装置如图1所示,_______ (填“a”或“b”)极为含有杂质的粗银,b极的电极反应式为_______ ,若b极有少量红棕色气体产生,则生成该气体的电极反应式为_______ 。

②氯碱工业:用离子交换膜法电解饱和食盐水的装置如图2所示,①口有带刺激性气味的气体逸出,则A为外电源的_______ 极,与B相连的电极的电极反应式为_______ 。为了获得产品( 和
和 ),应选用
),应选用_______ (填“阴”或“阳”)离子交换膜。
(1)一种利用垃圾渗滤液中
 、
、 发电的原理如图所示。
发电的原理如图所示。
①X为该装置的
②写出Y极的电极反应式:
(2)电解池在生产中有广泛的应用。
①工业上电解精炼银的装置如图1所示,

②氯碱工业:用离子交换膜法电解饱和食盐水的装置如图2所示,①口有带刺激性气味的气体逸出,则A为外电源的
 和
和 ),应选用
),应选用
您最近一年使用:0次
2022-05-20更新
|
262次组卷
|
3卷引用:陕西省延安市富县高级中学2021-2022学年高一下学期期末考试化学试题(B卷)
名校
解题方法
5 . 水体中的六价铬[Cr(Ⅵ)]对生态环境和人体健康威胁很大。工业废水中[Cr(Ⅵ)]常用还原沉淀法、微生物法等进行处理。
(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
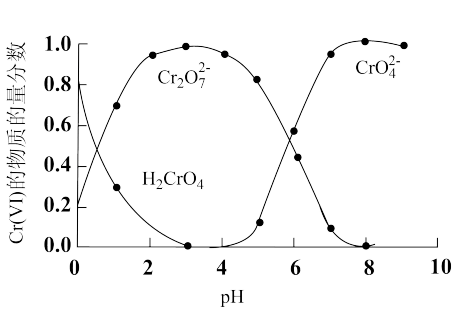
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:_______ 。[已知pH=3时,Cr(Ⅲ)以Cr3+形式存在,pH=7.5时,Cr(Ⅲ)开始沉淀]。
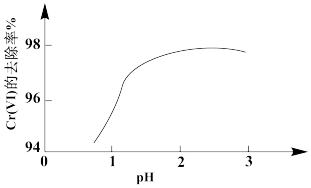
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是_______ 。
③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是_______ 。
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:_______ 。
②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是_______ 。
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为_______ 。

(1)“还原沉淀法”常用Na2SO3、FeSO4等处理Cr(Ⅵ)得到Cr(Ⅲ)。已知溶液中含Cr(Ⅵ)的微粒(H2CrO4、Cr2O
 和CrO
和CrO )的物质的量分数随pH的关系如图所示。
)的物质的量分数随pH的关系如图所示。
①某含Cr(Ⅵ)废水的pH约为8,写出用Na2SO3处理该废水的主要离子方程式:
②其他条件相同,用Na2SO3处理不同pH含Cr(Ⅵ)的废水,反应相同时间,Cr(Ⅵ)的去除率与pH的关系如图所示。已知酸性条件下Cr(Ⅵ)对Na2SO3具有很强的氧化能力,pH<2时,Cr(Ⅵ)的去除率随pH降低而降低的原因是

③研究发现,用FeSO4处理pH=3的含Cr(Ⅵ)废水,Cr(Ⅵ)的去除率大于其被FeSO4还原的理论值。Cr(Ⅵ)的去除率大于理论值的原因是
(2)“微生物法”处理含Cr(Ⅵ)废水具有效率高、选择性强、吸附容量大等优点。一种微生物法是用硫酸盐还原菌(SRB)处理含Cr(Ⅵ)废水。
①硫酸盐还原菌能将水中的SO
 转化为S2-,S2-与CrO
转化为S2-,S2-与CrO 可反应生成Cr2S3和S两种沉淀。写出S2-与CrO
可反应生成Cr2S3和S两种沉淀。写出S2-与CrO 反应的离子方程式:
反应的离子方程式:②用硫酸盐还原菌(SRB)处理含铬废水时,温度常控制在30℃左右,温度过高,Cr(Ⅵ)的去除率低的原因是
③硫酸盐还原菌(SRB)常存在于水体中,会腐蚀许多金属及合金。一种Fe合金在硫酸盐还原菌存在条件下腐蚀的机理如图所示。已知溶液中的S2-会完全转化为FeS,则Fe腐蚀后生成Fe(OH)2和FeS的物质的量之比为

您最近一年使用:0次
2022-04-19更新
|
372次组卷
|
5卷引用:江苏省镇江市五校2021-2022学年高二下学期期末考试化学试题
解题方法
6 . I.一种利用电化学原理治污的装置如下图,其反应原理是6NO2+8NH3=7N2+12H2O
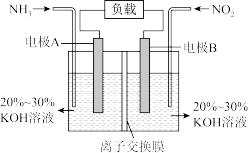
(1)A电极的电极反应式为___________ 。
(2)下列关于该电池说法正确的是___________(填序号)。
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。
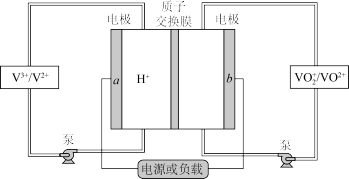
(3)电极b为___________ 极(填“正”或“负”)。充电时,该电极的反应为___________ 。
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
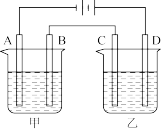
①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗___________ mol H+。
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为___________ mol。
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上___________ (填“嵌入”或“迁出”)。

(1)A电极的电极反应式为
(2)下列关于该电池说法正确的是___________(填序号)。
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电池工作一段时间,溶液的pH不变 |
| D.当有44.8 LNO2被处理时,转移电子的物质的量为8 mol |
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。

(3)电极b为
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上
您最近一年使用:0次
7 . 金属铁、铝可用于含铬(主要成份是 )酸性污水的处理。
)酸性污水的处理。
(1)铝在含铬污水中将 还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水,
还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水, 去除率与反应时间的关系如图1。
去除率与反应时间的关系如图1。

①基态Cr3+的核外电子排布式为___________ 。
②铝处理酸性含铬污水发生反应的离子方程式为___________ 。
③铝处理初始pH=3的污水,前180min污水中 的还原较慢,180min后变快,其原因是
的还原较慢,180min后变快,其原因是___________ 。
(2)将铁屑装入玻璃管中制成如图2所示污水处理柱。以同样的流速缓慢通入不同高度的处理柱进行酸性含铬污水处理实验,处理柱失活的时间与处理柱中铁屑高度的关系如图3。

①铁屑的高度为27cm时,处理柱的失活时间不增反降,其可能的原因是___________ 。
②铁屑中掺入一定量炭黑,污水的处理效果明显提高,炭黑的作用是___________ 。
③铁处理后的废水加入石灰调节pH=9,同时通入适量的空气,其目的是___________ 。
 )酸性污水的处理。
)酸性污水的处理。(1)铝在含铬污水中将
 还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水,
还原为Cr3+,再调节pH生成Cr(OH)3沉淀除去。用铝处理不同初始pH的酸性含铬污水, 去除率与反应时间的关系如图1。
去除率与反应时间的关系如图1。
①基态Cr3+的核外电子排布式为
②铝处理酸性含铬污水发生反应的离子方程式为
③铝处理初始pH=3的污水,前180min污水中
 的还原较慢,180min后变快,其原因是
的还原较慢,180min后变快,其原因是(2)将铁屑装入玻璃管中制成如图2所示污水处理柱。以同样的流速缓慢通入不同高度的处理柱进行酸性含铬污水处理实验,处理柱失活的时间与处理柱中铁屑高度的关系如图3。

①铁屑的高度为27cm时,处理柱的失活时间不增反降,其可能的原因是
②铁屑中掺入一定量炭黑,污水的处理效果明显提高,炭黑的作用是
③铁处理后的废水加入石灰调节pH=9,同时通入适量的空气,其目的是
您最近一年使用:0次
解题方法
8 . 载人航天工程对科学研究及太空资源开发具有重要意义,其发展水平是衡量一个国家综合国力的重要指标。中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩渺星辰的征途。
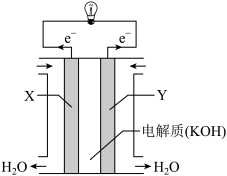
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的______ 极,OH-向______ (填“正”或“负”)极作定向移动,Y极的电极反应式为___________ 。
(2)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将______ 能转化为______ 能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为:Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为
Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为_______ ;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性________ (填“增强”“减弱”或“不变”)。
②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O 2Ag+Zn(OH)2,其负极的电极反应式为
2Ag+Zn(OH)2,其负极的电极反应式为_________ 。
(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的

(2)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。
①飞船在光照区运行时,太阳能电池帆板将
 Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为
Cd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O
 2Ag+Zn(OH)2,其负极的电极反应式为
2Ag+Zn(OH)2,其负极的电极反应式为
您最近一年使用:0次
2021-11-17更新
|
884次组卷
|
4卷引用:天津市红桥区2023-2024学年高二上学期期末考试化学试题
天津市红桥区2023-2024学年高二上学期期末考试化学试题山东省泰安肥城市2021-2022学年高二上学期期中考试化学试题第四章化学反应与电能(已下线)专题突破卷07 化学反应与能量?-2024年高考化学一轮复习考点通关卷(新教材新高考)
名校
解题方法
9 . 按要求完成下列问题。
(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:

①HS-在硫氧化菌作用下转化为 的电极反应式是
的电极反应式是_______ 。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是_______ 。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______ (填“负极”或“正极”)移动。
②负极反应式为_______ 。
③电路中每转移0.2mol电子,理论上生成_______ gPb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如下图所示。

①a电极的电极反应式是_______ ;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_______ 。
(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:

①HS-在硫氧化菌作用下转化为
 的电极反应式是
的电极反应式是②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是
(2)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向
②负极反应式为
③电路中每转移0.2mol电子,理论上生成
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如下图所示。

①a电极的电极反应式是
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是
您最近一年使用:0次
解题方法
10 . 如图所示,是原电池的装置图。请回答:

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为___________ 。
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为___________ , B 极电极反应式为___________ 。
(3)若 C 为 CuCl2溶液,Zn 是___________ 极(填正极或负极),Cu 极发生___________ 反应(填氧化或还原),Cu 极电极反应为___________ 。
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为___________ ,若线路中转移 2 mol 电子,则上述 CH3OH 燃料电池,消耗的 O2 在标准状况下的体积为___________ L。

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为
(3)若 C 为 CuCl2溶液,Zn 是
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为
您最近一年使用:0次



