名校
解题方法
1 . 化学电源在生产生活中有着广泛的应用,请回答下列问颕:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)电子表和电子计算器中所用的是钮扣式的微型银锌电池,其电极分别为 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: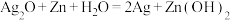 。
。
①工作时电流从___________ 极流向___________ 极(两空均选填“ ”或“Zn”);
”或“Zn”);
②负极的电极反应式为:___________ ;
③工作时电池正极区的pH___________ (选填“增大”“减小”或“不变”);
④外电路中每通过0.2mol电子,锌的质量理论上减少___________ g。
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“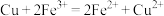 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:
①该电池的负极材料是___________ (填化学式),电解质溶液是___________ (填化学式)溶液。
②正极上发生的电极反应为___________ 。
③若导线上转移的电子为1mol,则消耗的金属铜的质量为___________ 。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
A.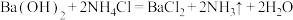 |
B. |
C. |
D. |
 和Zn,电解液为KOH溶液。工作时电池总反应为:
和Zn,电解液为KOH溶液。工作时电池总反应为: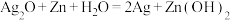 。
。①工作时电流从
 ”或“Zn”);
”或“Zn”);②负极的电极反应式为:
③工作时电池正极区的pH
④外电路中每通过0.2mol电子,锌的质量理论上减少
(3)理论上,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
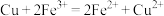 ”设计一种化学电池(正极材料用石墨棒),回答下列问题:
”设计一种化学电池(正极材料用石墨棒),回答下列问题:①该电池的负极材料是
②正极上发生的电极反应为
③若导线上转移的电子为1mol,则消耗的金属铜的质量为
您最近一年使用:0次
名校
解题方法
2 . 原电池原理在工农业生产、日常生活、科学研究中具有广泛的应用。
(1)甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医约和橡胶等工业。某科研团队利用光催化制甲酸如图所示:已知: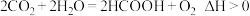 。
。
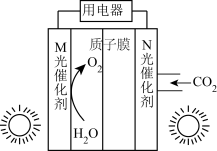
①两个电极中,电极电势较高的电极是___________ (填“M”或“N”)。
②正极电极反应式为___________ 。
③若制得 ,不考虑气体溶解,整套装置质量增加
,不考虑气体溶解,整套装置质量增加___________ g。
(2)热激活电池主要用于导弹、火箭以及应急电子仪器供电,是一种电解质受热熔融即可开始工作的电池。一种热激活电池的结构如图所示。
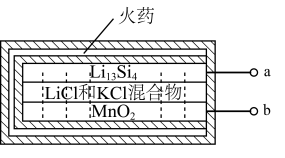
已知放电后的两极产物分别为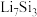 和
和 ,则a极的电极方程式为
,则a极的电极方程式为___________ 。
(3)我国《政府工作报告》写入“推动充电、加氢等设施的建设”。如下图是一种新型“全氢电池”,能量效率可达 。
。
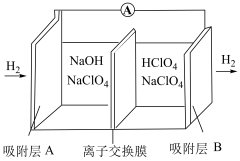
①该电池的总反应方程式为___________ 。
②该电池工作一段时间后,离子交换膜右侧质量增大,则透过离子交换膜迁移的离子是___________ 。
③该电池以恒定电流2A输出,当电池左侧消耗标况下 时,可持续对外供电
时,可持续对外供电___________ 小时(已知法拉第常数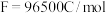 ,计算结果保留到整数)。
,计算结果保留到整数)。
(1)甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医约和橡胶等工业。某科研团队利用光催化制甲酸如图所示:已知:
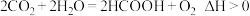 。
。
①两个电极中,电极电势较高的电极是
②正极电极反应式为
③若制得
 ,不考虑气体溶解,整套装置质量增加
,不考虑气体溶解,整套装置质量增加(2)热激活电池主要用于导弹、火箭以及应急电子仪器供电,是一种电解质受热熔融即可开始工作的电池。一种热激活电池的结构如图所示。

已知放电后的两极产物分别为
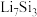 和
和 ,则a极的电极方程式为
,则a极的电极方程式为(3)我国《政府工作报告》写入“推动充电、加氢等设施的建设”。如下图是一种新型“全氢电池”,能量效率可达
 。
。
①该电池的总反应方程式为
②该电池工作一段时间后,离子交换膜右侧质量增大,则透过离子交换膜迁移的离子是
③该电池以恒定电流2A输出,当电池左侧消耗标况下
 时,可持续对外供电
时,可持续对外供电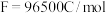 ,计算结果保留到整数)。
,计算结果保留到整数)。
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):
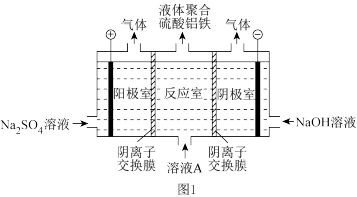
①电解过程阳极室溶液 pH 的变化是___________ (填“增大”、“减小”或“不变”)。
②简述在反应室中生成液体聚合硫酸铝铁的原理___________ 。
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为___________ 。。
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是___________ g。
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。
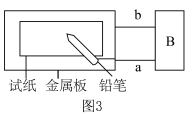
①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色___________ 。
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为___________ 。
(1)电解硫酸亚铁和硫酸铝溶液得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图1所示(阴离子交换膜只允许阴离子通过,电极为惰性电极):

①电解过程阳极室溶液 pH 的变化是
②简述在反应室中生成液体聚合硫酸铝铁的原理
(2)如图2是一种用电解原理来制备 H2O2,并用产生的 H2O2处理废氨水的装置。

①Ir-Ru 惰性电极吸附 O2生成 H2O2,其电极反应式为
②理论上电路中每转移3 mol e-,最多可以处理废氨水中溶质(以NH3计)的质量是
(3)为探究金属的腐蚀情况,某同学取一张用饱和 NaCl 溶液浸湿的石蕊试纸,平铺在一块金属板上,按如图3所示的方法连接电路。

①若试纸为红色石蕊试纸,金属板为一锌片,B 处为一灵敏电流计,接通电路,将铅笔芯(主要成分为石墨)放置在试纸上一段时间,发现电流计指针发生偏转,则铅笔芯与试纸接触处颜色
②若金属板为一铂片,B 处为一直流电源,接通电源后,若试纸为蓝色石蕊试纸,将铅笔芯放置在试纸上一段时间后,若接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,则铅笔芯与试纸接触处的电极反应式为
您最近一年使用:0次
2023-09-19更新
|
71次组卷
|
2卷引用:河北省唐县第一中学2023-2024学年高二上学期9月月考化学试题
名校
解题方法
4 . 氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
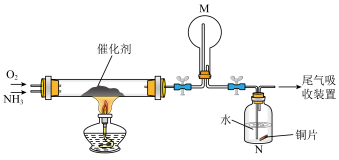
①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:___________ 。
(3)可用ClO2将氮氧化物转化成 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
(4)纳米铁粉可去除水体中的 。
。
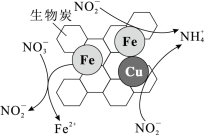
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是___________ 。
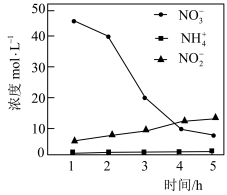
②控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:

①氨催化氧化时会生成副产物N2O。生成含等物质的量氮元素的NO与N2O时,消耗的O2的物质的量之比为
②一段时间后,观察到装置M中有白烟生成,该白烟成分是
(2)选择性催化还原法(SCR)工艺是以NH3 为还原剂,在催化剂作用下选择性地与NOx发生氧化还原反应生成无害化的N2和H2O。
已知:4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H1=-905.8 kJ/mol
N2(g)+ O2(g)=2NO(g) △H2 = +180 kJ/mol
则NH3与NO反应的热化学方程式为:
(3)可用ClO2将氮氧化物转化成
 。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向一定量ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为(4)纳米铁粉可去除水体中的
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是
②控制其他条件不变,用纳米铁粉还原水体中的
 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是
您最近一年使用:0次
名校
解题方法
5 . I.能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_____ (填序号)。
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(2)放电时负极反应为_____ 。
(3)放电时正极附近溶液的碱性_____ (填“增强”或“减弱”或“不变”)。
(4)放电时每转移_____ mol电子,正极有1molK2FeO4被还原。
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是_____ 。
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。_____ 。
(7)a膜为_____ (填“阳离子”或“阴离子”,下同)交换膜,b膜为_____ 交换膜。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
| A.CaO(s)+H2O(l)=Ca(OH)2(aq) | B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) |
| C.2CO(g)+O2(g)=2CO2(g) | D.Fe(s)+2FeCl3(aq)=3FeCl2(aq) |
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。(2)放电时负极反应为
(3)放电时正极附近溶液的碱性
(4)放电时每转移
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是
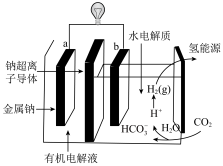
| A.Na+将从a极移动到b极 |
| B.该电池的电解液可以换成更易导电的饱和NaCl溶液 |
C.b极区可能会发生Na++HCO =NaHCO3↓ =NaHCO3↓ |
| D.b极区每生成1molH2转移2mol电子 |
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。

(7)a膜为
您最近一年使用:0次
2023-04-26更新
|
559次组卷
|
2卷引用:山东省淄博市高青县第一中学二部2023-2024学年高一下学期3月月考化学试题
名校
6 . 海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。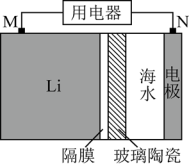
(1)N极为该电池的___________ 极。该电池的总反应为:___________
(2)N极上发生的电极反应为:___________ 、___________
(3)玻璃陶瓷的作用是___________

(1)N极为该电池的
(2)N极上发生的电极反应为:
(3)玻璃陶瓷的作用是
您最近一年使用:0次
名校
7 . 回答下列问题
(1)高铁酸钾( )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,其电池方程式为:
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,其电池方程式为: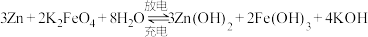 。如图1所示是高铁电池的模拟实验装置。
。如图1所示是高铁电池的模拟实验装置。


①该电池放电时正极反应式为_______ 。
②盐桥中盛有饱和 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向_______ (填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_______ 。
(2) 和
和 是主要大气污染物,利用如图装置可同时吸收
是主要大气污染物,利用如图装置可同时吸收 和
和 。
。

① 是直流电源的
是直流电源的_______ 极。
②已知电解池的阴极室中溶液的 在4~7之间,阴极的电极反应为
在4~7之间,阴极的电极反应为_______ 。
③用离子方程式表示吸收 的原理
的原理_______ 。
(1)高铁酸钾(
 )不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,其电池方程式为:
)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中,其电池方程式为: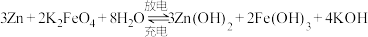 。如图1所示是高铁电池的模拟实验装置。
。如图1所示是高铁电池的模拟实验装置。

①该电池放电时正极反应式为
②盐桥中盛有饱和
 溶液,此盐桥中氯离子向
溶液,此盐桥中氯离子向③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
(2)
 和
和 是主要大气污染物,利用如图装置可同时吸收
是主要大气污染物,利用如图装置可同时吸收 和
和 。
。
①
 是直流电源的
是直流电源的②已知电解池的阴极室中溶液的
 在4~7之间,阴极的电极反应为
在4~7之间,阴极的电极反应为③用离子方程式表示吸收
 的原理
的原理
您最近一年使用:0次
8 . 能量转化是化学变化的主要特征之一,按要求回答下列问题。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是___________(填字母)。
(2)有关的电池装置如图:
①上述四种电池中,属于二次电池的是___________ (填字母)。
②a装置中,外电路中电子的流向是___________ (填“从Zn流向Cu”或“从Cu流向Zn”)。
③d装置放电时总反应为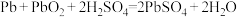 。写出放电时负极的电极反应式:
。写出放电时负极的电极反应式:___________ 。
(3)氧化还原反应一般可以设计成原电池。若将反应 设计成原电池,则:
设计成原电池,则:
①电池的负极材料是___________ ,负极发生___________ 反应(填“氧化”或“还原”,电解质溶液可以是:___________ ;
②正极上出现的现象是___________ ;
③当外电路中转移1mol 时,电解质溶液减少的质量是
时,电解质溶液减少的质量是___________ g。
(1)页岩气是从页岩层中开采出来的天然气,成分以甲烷为主,页岩气的资源潜力可能大于常规天然气。下列有关页岩气的叙述错误的是___________(填字母)。
| A.页岩气属于新能源 |
| B.页岩气和氧气的反应是放热反应 |
| C.甲烷中每个原子的最外层电子排布都达到8电子稳定结构 |
| D.页岩气可以作燃料电池的负极燃料 |
| 编号 | a | b | c | d |
| 电池装置 |  |  |  |  |
②a装置中,外电路中电子的流向是
③d装置放电时总反应为
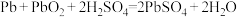 。写出放电时负极的电极反应式:
。写出放电时负极的电极反应式:(3)氧化还原反应一般可以设计成原电池。若将反应
 设计成原电池,则:
设计成原电池,则:①电池的负极材料是
②正极上出现的现象是
③当外电路中转移1mol
 时,电解质溶液减少的质量是
时,电解质溶液减少的质量是
您最近一年使用:0次
9 . 双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-,将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。
(1)海水淡化:模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。

①X极是___ 极。
②图中双极膜的右侧得到的是___ (填“H+”或“OH-”),电解后在___ 出口可获得较浓的盐酸(填“a”“b”或“c”)。
③电解过程中阳极区溶液中的n(OH-)___ (填“变大”“变小”或“基本不变”)。
(2)新型Zn—CO2水介质电池,为解决环境和能源问题提供了一种新途径。电池示意图如图,电极为金属锌和选择性催化材料。放电时温室气体CO2被转化为储氢物质甲酸等。

①放电时电池负极反应为___ 。
②放电时,1molCO2转化为HCOOH,转移的电子数为___ mol。
③充电时,电池总反应为___ 。
(1)海水淡化:模拟海水淡化,并获得浓盐酸和浓氢氧化钠溶液。双极膜组合电解装置示意图如图。

①X极是
②图中双极膜的右侧得到的是
③电解过程中阳极区溶液中的n(OH-)
(2)新型Zn—CO2水介质电池,为解决环境和能源问题提供了一种新途径。电池示意图如图,电极为金属锌和选择性催化材料。放电时温室气体CO2被转化为储氢物质甲酸等。

①放电时电池负极反应为
②放电时,1molCO2转化为HCOOH,转移的电子数为
③充电时,电池总反应为
您最近一年使用:0次
10 . 根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“ ”设计一个化学电池(正极材料用碳棒),回答下列问题:
”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是___________ ,发生___________ (填“氧化”或“还原”)反应,电解质溶液是___________ 。
(2)正极上出现的现象是___________ 。
(3)若导线上转移电子 ,则消耗铜
,则消耗铜___________  。
。
Ⅱ. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入 的
的 溶液中,乙同学将电极放入
溶液中,乙同学将电极放入 的
的 溶液中,如图所示。
溶液中,如图所示。
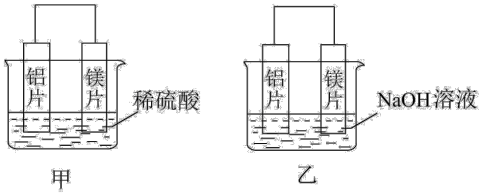
(4)写出甲中正极的电极反应式:___________ 。
(5)写出乙中总反应的离子方程式:___________ 。
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
 ”设计一个化学电池(正极材料用碳棒),回答下列问题:
”设计一个化学电池(正极材料用碳棒),回答下列问题:(1)该电池的负极材料是
(2)正极上出现的现象是
(3)若导线上转移电子
 ,则消耗铜
,则消耗铜 。
。Ⅱ. 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入
 的
的 溶液中,乙同学将电极放入
溶液中,乙同学将电极放入 的
的 溶液中,如图所示。
溶液中,如图所示。
(4)写出甲中正极的电极反应式:
(5)写出乙中总反应的离子方程式:
您最近一年使用:0次



