名校
1 . 能源的开发、利用与人类社会的可持续发展息息相关,充分利用好能源是摆在人类面前的重大课题。
(1)为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促进燃料循环使用的构想,如图所示:
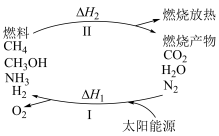
过程Ⅰ的能量转化形式为___________ 能转化为___________ 能。
(2)有机物M经过太阳光照射可转化成N,转化过程如下:
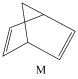

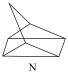 ΔH=+88.6kJ/mol
ΔH=+88.6kJ/mol
则M、N中,较稳定的是___________ 。
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如图所示:
太阳能→热能→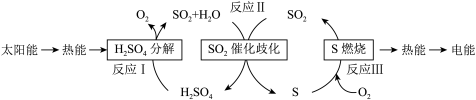
反应Ⅰ:2H2SO4(l) 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
反应Ⅲ:S(s)+O2(g) SO2(g) ΔH3=-297kJ/mol
SO2(g) ΔH3=-297kJ/mol
写出反应Ⅱ的热化学方程式:___________ 。
(4)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________(填标号)。
(5)如图所示的装置中,X、Y都是惰性电极。将电路接通后,向乙装置中滴入无色酚酞溶液,Fe极附近显红色。
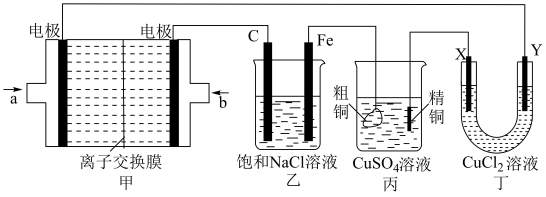
①甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上的电极反应式是___________ 。
②乙装置中,总反应的离子方程式是___________ 。
③若丙装置中精铜电极的质量增加了6.4g,则甲装置中标准状况下消耗的CH4的体积为___________ 。
(1)为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有专家提出利用太阳能促进燃料循环使用的构想,如图所示:

过程Ⅰ的能量转化形式为
(2)有机物M经过太阳光照射可转化成N,转化过程如下:


 ΔH=+88.6kJ/mol
ΔH=+88.6kJ/mol则M、N中,较稳定的是
(3)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。其过程如图所示:
太阳能→热能→

反应Ⅰ:2H2SO4(l)
 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551kJ/mol反应Ⅲ:S(s)+O2(g)
 SO2(g) ΔH3=-297kJ/mol
SO2(g) ΔH3=-297kJ/mol写出反应Ⅱ的热化学方程式:
(4)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是___________(填标号)。
| A.C(s)+CO2(g)=2CO(g) ΔH>0 |
| B.4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH<0 |
| C.NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) ΔH<0 |
| D.C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH<0 |
(5)如图所示的装置中,X、Y都是惰性电极。将电路接通后,向乙装置中滴入无色酚酞溶液,Fe极附近显红色。

①甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,电极a上的电极反应式是
②乙装置中,总反应的离子方程式是
③若丙装置中精铜电极的质量增加了6.4g,则甲装置中标准状况下消耗的CH4的体积为
您最近一年使用:0次
2 . 大多数化学反应都是可逆反应,某小组利用0.1 mol/L KI溶液和0.1 mol/LFeCl3溶液通过实验验证2I-+2Fe3+ 2Fe2++I2为可逆反应。回答下列问题:
2Fe2++I2为可逆反应。回答下列问题:
(1)配制100 mL 0.1000 mol/L KI溶液,需称量固体KI_______ g (精确到0.01)。
(2)实验验证:取1.0 mL 0.1 mol/LKI溶液和1.0 mL 0.1 mol/L FeCl3溶液于试中,充分反应后,滴加几滴KSCN溶液,观察到_______ 证明该反应为可逆反应。
(3)实验探究:向盛有6 mL 0.1 mol/LKI溶液的试管中加入1 mL 0.1 mol/LFeCl3溶液反应后溶液呈黄色;取出2.0 mL反应后混合液,加入2.0 mLCCl4,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色。
①若要检验萃取后的上层淡黄色溶液中是否含碘单质,可以进行的实验操作是_______ 。
②实验中KI溶液过量的目的是_______ 。
(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的0.1 mol/LKI溶液、0.1 mol/L FeCl3溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是_______ 。
②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体_______ (填标号),可观察到灵敏电流计指针向左偏转。
A. FeCl2 B. FeCl3 C. I2
(5)写出氯化铁在生活中的一种用途:_______ 。
 2Fe2++I2为可逆反应。回答下列问题:
2Fe2++I2为可逆反应。回答下列问题:(1)配制100 mL 0.1000 mol/L KI溶液,需称量固体KI
(2)实验验证:取1.0 mL 0.1 mol/LKI溶液和1.0 mL 0.1 mol/L FeCl3溶液于试中,充分反应后,滴加几滴KSCN溶液,观察到
(3)实验探究:向盛有6 mL 0.1 mol/LKI溶液的试管中加入1 mL 0.1 mol/LFeCl3溶液反应后溶液呈黄色;取出2.0 mL反应后混合液,加入2.0 mLCCl4,振荡、静置,液体分层,下层溶液呈紫红色,上层溶液呈淡黄色。
①若要检验萃取后的上层淡黄色溶液中是否含碘单质,可以进行的实验操作是
②实验中KI溶液过量的目的是
(4)有小组同学采用电化学装置(如图所示)从平衡移动的角度进行了验证。

①向烧杯中分别加入相同体积的0.1 mol/LKI溶液、0.1 mol/L FeCl3溶液,观察到灵敏电流计指针向右偏转(电流方向为从左至右),则乙烧杯中加入的溶液是
②随着反应的进行,灵敏电流计指针偏转幅度不断减小,一段时间后示数为0,此时向甲烧杯中加入一定量固体
A. FeCl2 B. FeCl3 C. I2
(5)写出氯化铁在生活中的一种用途:
您最近一年使用:0次
名校
解题方法
3 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
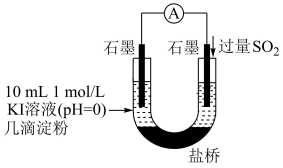
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
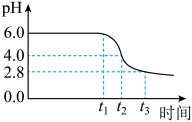
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
344次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
名校
解题方法
5 . 某实验小组学生为探究氧化性: Br2 > Fe3+ > I2,设计下列实验方案。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
(1)FeCl3溶液的配制:取FeCl3固体溶于___________ ,再稀释至指定浓度。配制250mL 0.1mol/L FeCl3溶液,需5.0 mol/L FeCl3溶液的体积为___________ mL,配制过程,图中不需要使用的仪器有___________ (填仪器名称)。

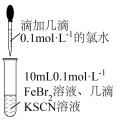
(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是___________ 。
(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
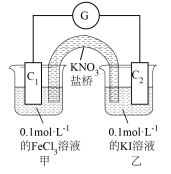
①通过外电路中电子流向:___________ (用C1、C2和→表示),可证明氧化性: 。
。
②也可通过甲池中颜色变化证明,甲池中颜色变化为___________ 。
(4)化学能可转化为电能,写出其在生活中常见的一种应用___________ 。
【查阅资料】电极电势如下表:(已知:电极电势越高,氧化性越强)
| 氧化还原电对(氧化型/还原型) | 电极反应式(氧化型+ne-=还原型) | 电极电势(E0/V) |
| Fe3+ +/ Fe2 | Fe3+ + e- = Fe2+ | 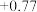 |
| I2 /I- | I2 + 2e- = 2I- | 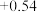 |
| Br2 /Br- | Br2 + 2e- = 2 Br- | 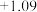 |

(2)利用FeBr2和氯水,设计实验证明氧化性:Br2 > Fe3+,实验如图所示,实验过程中,能证明氧化性:Br2 > Fe3+的现象是

(3)利用0.1mol/L的FeCl3溶液和0.1mol/L的
 溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
溶液,不用任何试剂证明氧化性:Fe3+ > I2,FeCl3溶液和碘水颜色相近,设计的实验装置如图,实验过程中,电流计指针偏转,说明反应发生。
①通过外电路中电子流向:
 。
。②也可通过甲池中颜色变化证明,甲池中颜色变化为
(4)化学能可转化为电能,写出其在生活中常见的一种应用
您最近一年使用:0次
名校
6 . 中国明确提出2030年“碳达峰”与2060年“碳中和”目标。 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:
Ⅰ.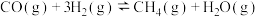
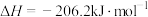
Ⅱ.
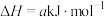
回答下列问题:
(1)已知
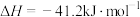 ,则
,则
_______ 。
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中 的转化率
的转化率_______ 、_______ 、_______ 。
(3)400℃时,选用镍基催化剂,向 密闭容器中通入
密闭容器中通入 、
、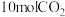 和
和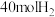 进行反应,平衡后测得
进行反应,平衡后测得 ,
,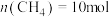 。
。
① 的平衡转化率为
的平衡转化率为_______ 。
②反应Ⅱ平衡常数K的数值最接近下列哪个数值_______ (填字母)。
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
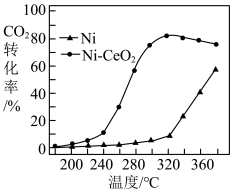
①请解释使用 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低_____ ?
②根据图像分析,下列说法错误的是_______ (填字母)。
A.在200~360℃范围内, 的催化效果比
的催化效果比 更好
更好
B.可以通过改变催化剂种类的方式调控 平衡转化率
平衡转化率
C.在240℃附近,可以通过延长反应时间的方式提高 的转化率
的转化率
(5) 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
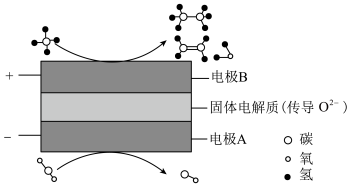
①阴极上的反应式为_______ 。
②阳极上生成乙烯 和乙烷
和乙烷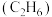 的反应式分别为
的反应式分别为_______ 和_______ 。
③若生成的乙烯 和乙烷
和乙烷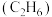 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为_______ 。
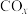 选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下,
选择性甲烷化是有望实现“双碳目标”具有良好应用前景的处理方法。富氢气氛下, 、
、 均可与
均可与 发生甲烷化反应:
发生甲烷化反应:Ⅰ.
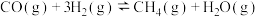
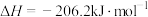
Ⅱ.

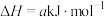
回答下列问题:
(1)已知

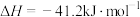 ,则
,则
(2)请从平衡移动的角度,提出三种可行的操作提高反应Ⅰ中
 的转化率
的转化率(3)400℃时,选用镍基催化剂,向
 密闭容器中通入
密闭容器中通入 、
、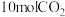 和
和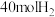 进行反应,平衡后测得
进行反应,平衡后测得 ,
,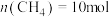 。
。①
 的平衡转化率为
的平衡转化率为②反应Ⅱ平衡常数K的数值最接近下列哪个数值
A.20 B.2 C.0.2 D.0.02
(4)其他条件相同,反应Ⅱ使用两种不同催化剂,反应相同的时间,测得
 的转化率随温度变化的影响如图所示。
的转化率随温度变化的影响如图所示。
①请解释使用
 催化剂时,随着温度的升高,为何
催化剂时,随着温度的升高,为何 转化率先升高后降低
转化率先升高后降低②根据图像分析,下列说法错误的是
A.在200~360℃范围内,
 的催化效果比
的催化效果比 更好
更好B.可以通过改变催化剂种类的方式调控
 平衡转化率
平衡转化率C.在240℃附近,可以通过延长反应时间的方式提高
 的转化率
的转化率(5)
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为
②阳极上生成乙烯
 和乙烷
和乙烷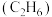 的反应式分别为
的反应式分别为③若生成的乙烯
 和乙烷
和乙烷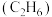 的体积比为
的体积比为 ,则消耗的
,则消耗的 和
和 的体积比为
的体积比为
您最近一年使用:0次
名校
7 . 某小组同学实验验证“ ”为可逆反应。
”为可逆反应。
(1)实验验证
实验Ⅰ:将含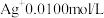 的溶液与
的溶液与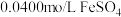 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。
实验Ⅱ:向少量Ag粉中加入 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。
①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:___________ 。
②Ⅱ中溶液选用 ,不选用
,不选用 的原因为
的原因为___________ 。
综合上述实验,证实“ ”为可逆反应。
”为可逆反应。
(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为___________ 溶液;b为___________ 溶液;(写a、b化学式)
②再向左侧烧杯中滴加较浓的___________ 溶液(填化学式),产生的现象为___________ ,表明“ ”为可逆反应。
”为可逆反应。
 ”为可逆反应。
”为可逆反应。(1)实验验证
实验Ⅰ:将含
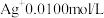 的溶液与
的溶液与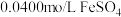 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。
)等体积混合,产生灰黑色沉淀,溶液呈黄色。实验Ⅱ:向少量Ag粉中加入
 溶液(
溶液( ),固体完全溶解。
),固体完全溶解。①取Ⅰ中沉淀,加入浓硝酸,证实灰黑色沉淀为Ag。请写出该反应的离子方程式:
②Ⅱ中溶液选用
 ,不选用
,不选用 的原因为
的原因为综合上述实验,证实“
 ”为可逆反应。
”为可逆反应。(2)采用电化学装置进行验证。
小组同学设计如图电化学装置进行实验:

①按照上图的装置图,组装好仪器后,分别在两烧杯中加入一定浓度的a、b两电解质溶液,闭合开关K,观察到的现象为:Ag电极上有灰黑色固体析出,指针向右偏转,一段时间后指针归零,说明此时反应达到平衡。则a为
②再向左侧烧杯中滴加较浓的
 ”为可逆反应。
”为可逆反应。
您最近一年使用:0次
名校
解题方法
8 . 砷及其化合物是实验研究热点物质。某小组开展对砷的化学物研究。
实验1:资料显示,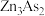 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
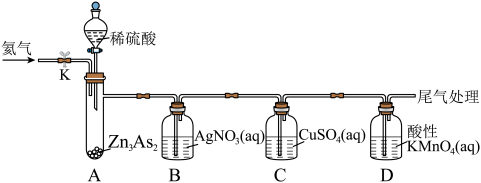
(1)A装置中盛装稀硫酸的仪器名称是___________ 。B装置中发生氧化还原反应,生成一种由过滤元素组成的黑色固体单质,该固体单质的化学式为___________ 。
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为___________ 。
(3)D装置中溶液由紫红色变为无色,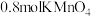 恰好氧化
恰好氧化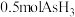 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为___________ 。
实验2:查阅资料发现, 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
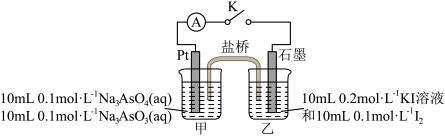
(4)根据步骤Ⅲ中电流表读数 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
___________ 0(填“>”或“<”)。请具体说明如何根据电流表读数 可判断此反应是可逆反应:
可判断此反应是可逆反应:___________ 。
(5)根据上述探究, 和
和 能否发生反应与
能否发生反应与___________ 有关(填序号)。
①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为___________ 。
实验1:资料显示,
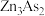 可与稀硫酸反应生成
可与稀硫酸反应生成 。设计如图装置探究
。设计如图装置探究 的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
的性质(反应开始前,向装置中通入氦气,一段时间后,关闭弹簧夹K)。
(1)A装置中盛装稀硫酸的仪器名称是
(2)已知:C装置中反应生成砷化亚铜固体、一种常见的最高价含氧酸和一种固体单质,则该反应的化学方程式为
(3)D装置中溶液由紫红色变为无色,
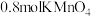 恰好氧化
恰好氧化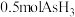 ,则氧化产物中砷元素的化合价为
,则氧化产物中砷元素的化合价为实验2:查阅资料发现,
 和
和 的氧化性差异不大。推测在一定条件下
的氧化性差异不大。推测在一定条件下 和
和 反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
反应可能是可逆反应。用如图所示装置进行探究。连接装置(盐桥中的物质不参与反应),进行下表中实验操作并记录电流表读数。
| 序号 | 实验步骤 | 电流表读数(A) |
| Ⅰ | 按图2所示连接装置并加入药品,闭合开关K。向甲烧杯中滴加浓NaOH溶液,电流表指针偏转,乙烧杯中溶液颜色变浅,读出电流表读数为 |  |
| Ⅱ | 充分反应一段时间后,读出电流表读数为 | 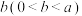 |
| Ⅲ | 当电流表读数为0时,向甲烧杯中缓缓加入稀硫酸,读出电流表读数为 |  |
 ,可以确定上述反应是可逆反应,则读数
,可以确定上述反应是可逆反应,则读数
 可判断此反应是可逆反应:
可判断此反应是可逆反应:(5)根据上述探究,
 和
和 能否发生反应与
能否发生反应与①浓度 ②温度 ③pH ④催化剂
向甲烧杯中滴加稀硫酸后,装置中发生的总反应的离子方程式为
您最近一年使用:0次
2023-10-09更新
|
123次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
名校
解题方法
9 . 探究硫及其化合物的转化,有重要的现实意义。一定温度下,恒压密闭容器中发生反应2SO2(g)+O2(g)  2SO3(g),
2SO3(g),
(1)精制炉气各组分的体积分数 为
为 、
、 为b%(b>0.5a),
为b%(b>0.5a), 为
为 。选择五氧化二钒(
。选择五氧化二钒( )作催化剂合成
)作催化剂合成 的平衡转化率与反应温度和压强的关系如图所示。
的平衡转化率与反应温度和压强的关系如图所示。
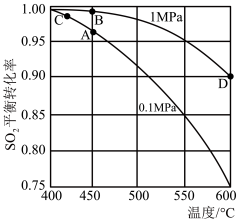
①催化反应过程中 与
与 相互转化,写出生成
相互转化,写出生成 这一步的反应方程式
这一步的反应方程式_______ 。
②实际生产选择图中 点的反应条件,不选择
点的反应条件,不选择 、
、 点理由分别是
点理由分别是______ 。
③计算, 点
点 的体积分数是
的体积分数是_______ (用含有 的代数式表示)。
的代数式表示)。
(2)工业上一般选用浓硫酸吸收 ,得到一种液态物质
,得到一种液态物质 ,取5.16X与足量
,取5.16X与足量 溶液反应仅生成
溶液反应仅生成 难溶性盐(白色沉淀)和水,则液态物质
难溶性盐(白色沉淀)和水,则液态物质 的化学式为
的化学式为_______ 。
(3)若将该反应设计程原电池,熔融硫酸钠作为电解质,正负极为惰性电极,二氧化硫参与反应的电极名称为_______ 极,电极反应式为:_______ 。正极通入的是混合气体,其成分为_______ 。
 2SO3(g),
2SO3(g),
(1)精制炉气各组分的体积分数
 为
为 、
、 为b%(b>0.5a),
为b%(b>0.5a), 为
为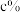 。选择五氧化二钒(
。选择五氧化二钒( )作催化剂合成
)作催化剂合成 的平衡转化率与反应温度和压强的关系如图所示。
的平衡转化率与反应温度和压强的关系如图所示。
①催化反应过程中
 与
与 相互转化,写出生成
相互转化,写出生成 这一步的反应方程式
这一步的反应方程式②实际生产选择图中
 点的反应条件,不选择
点的反应条件,不选择 、
、 点理由分别是
点理由分别是③计算,
 点
点 的体积分数是
的体积分数是 的代数式表示)。
的代数式表示)。(2)工业上一般选用浓硫酸吸收
 ,得到一种液态物质
,得到一种液态物质 ,取5.16X与足量
,取5.16X与足量 溶液反应仅生成
溶液反应仅生成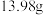 难溶性盐(白色沉淀)和水,则液态物质
难溶性盐(白色沉淀)和水,则液态物质 的化学式为
的化学式为(3)若将该反应设计程原电池,熔融硫酸钠作为电解质,正负极为惰性电极,二氧化硫参与反应的电极名称为
您最近一年使用:0次
10 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。硝基苯是一种具有稳定化学性质、高毒性、难生物降解的污染物。工业上采用吸附、还原、氧化等方法可有效降解废水中的硝基苯。
(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:______________________ (请从平衡移动角度解释)。

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:___________ 。
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯( ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:___________ 。
③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:___________ 。

(3)研究发现, 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:___________ 。
(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是___________ 。[已知氧化性: ]
]

(1)活性炭因为有较大的比表面积、多孔结构而具有较强的吸附能力,其物理吸附平衡建立如图所示。活性炭处理低浓度的硝基苯废水时,当温度超过50℃,活性炭对硝基苯的吸附量显著下降,原因是:

(2)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图所示。铁炭混合物中极小颗粒的炭分散在铁屑内,具有吸附作用,同时作正极材料构成原电池加快反应速率,还能防止铁屑结块。

①该物质转化示意图可以描述为:
②酸性环境中,铁炭混合物处理硝基苯废水,难生物降解的硝基苯首先被还原为亚硝基苯(
 ),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:
),然后进一步被还原成可生物降解的苯胺,写出生成亚硝基苯的电极反应式:③其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图所示。pH越大,硝基苯的去除率越低的原因是:

(3)研究发现,
 在
在 作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含
作用下能够生成羟基自由基(HO·)。HO·具有很强的氧化作用,是氧化硝基苯的有效因子。向含 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:
)的酸性溶液中加入双氧水,写出生成HO·的离子反应方程式:(4)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图所示。反应相同时间,初始溶液
 时苯胺浓度大于
时苯胺浓度大于 时的原因是
时的原因是 ]
]
您最近一年使用:0次