名校
解题方法
1 . 为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
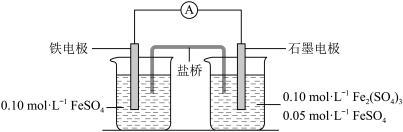
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol/LFeSO4溶液,需要的仪器有药匙、玻璃棒、_______ (填序号)。
A. B.
B. 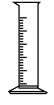 C.
C. 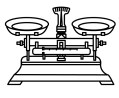 D.
D. 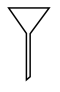 E.
E.
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择___________ (物质化学式)作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入___________ 电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+ )增加了0.02 mol/L。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=___________ 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为___________ ,铁电极的电极反应式为___________ 。因此,验证了Fe2+氧化性小于___________ ,还原性小于___________ 。
(6)实验前需要对铁电极表面活化。在FeSO4 溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是___________ 。

回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol/LFeSO4溶液,需要的仪器有药匙、玻璃棒、
A.
 B.
B.  C.
C.  D.
D.  E.
E.
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | u∞×108/(m2·s-1·v-1) | 阴离子 | u∞×108/(m2·s-1·v-1) |
| Li+ | 4.07. |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl- | 7.91 |
| K+ | 7.62 |  | 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+ )增加了0.02 mol/L。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为
(6)实验前需要对铁电极表面活化。在FeSO4 溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
您最近一年使用:0次
名校
解题方法
2 . 碱性银锌二次航空电池为价格昂贵的高能电池。该电池的总反应为: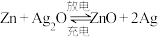 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
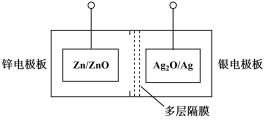
(1)该电池放电时,银电极板为电池的___________ (填“正极”或“负极”)。
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:
补充反应ⅰ:___________ 。
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:_______ 。
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
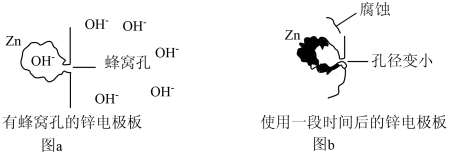
下列说法正确的是___________ (填字母序号)。
a.充电时, 向锌极板方向迁移
向锌极板方向迁移
b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外 浓度高于孔内
浓度高于孔内 浓度
浓度
d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
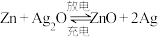 ,其电池中的基本单元示意图如下:
,其电池中的基本单元示意图如下:
(1)该电池放电时,银电极板为电池的
(2)以KOH溶液为电解液,放电时锌电极板区域中发生的电极反应可分为两步:
反应ⅰ.锌电极板的溶解:∙∙∙∙∙∙
反应ⅱ.锌电极板上ZnO的析出:

补充反应ⅰ:
(3)放电时,析出的ZnO会覆盖在锌电极板表面,影响电池使用效果。用浓KOH溶液可以抑制ZnO的生成,并促进锌电极板的溶解,请结合化学用语,从速率和平衡的角度说明原因:
(4)将锌电极板制成蜂窝孔状,如图a所示,能增大锌电极板的表面积,但蜂窝孔的孔径过小,影响
 进出蜂窝孔的速率,导致孔径内外
进出蜂窝孔的速率,导致孔径内外 浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
浓度出现差异,多次充放电后会影响锌电极板的形状。图b是使用一段时间后的锌极板变形情况。
下列说法正确的是
a.充电时,
 向锌极板方向迁移
向锌极板方向迁移b.孔内沉积ZnO,导电能力减弱,影响电池使用效果
c.导致该腐蚀变形的主要原因是孔外
 浓度高于孔内
浓度高于孔内 浓度
浓度d.为延长电池使用寿命,提高电池放电效果,应选用孔径恰当的锌极板
您最近一年使用:0次
解题方法
3 . 近日,科学家设计一种具有石墨正极的高容量可充电 锂金属电池,原理如图所示。氯化铝(
锂金属电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(
)中,以氟化物( )为添加剂作为电解质。回答下列问题:
)为添加剂作为电解质。回答下列问题:
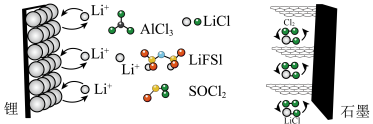
(1)放电时,能量主要转化形式是___________ 。
(2)放电时,锂离子由___________ (填“锂”或“石墨”,下同)极向___________ 极迁移,石墨极反应式为___________ 。
(3)充电时,石墨极与电源___________ (填“正”或“负”)极连接。转移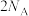 个电子时锂电极理论上净增
个电子时锂电极理论上净增___________ g锂( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(4)该装置不能使用水、醇、酸作溶剂,其理由是___________ 。
(5) 在
在 中完全燃烧放出热量为
中完全燃烧放出热量为 。写出热化学方程式:
。写出热化学方程式:___________ 。
(6)工业上制备亚硫酰氯: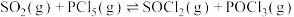
 。下列措施能提高
。下列措施能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。
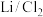 锂金属电池,原理如图所示。氯化铝(
锂金属电池,原理如图所示。氯化铝( )溶解在亚硫酰氯(
)溶解在亚硫酰氯( )中,以氟化物(
)中,以氟化物( )为添加剂作为电解质。回答下列问题:
)为添加剂作为电解质。回答下列问题: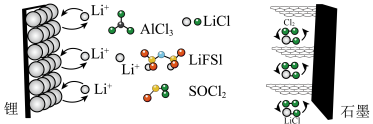
(1)放电时,能量主要转化形式是
(2)放电时,锂离子由
(3)充电时,石墨极与电源
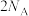 个电子时锂电极理论上净增
个电子时锂电极理论上净增 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(4)该装置不能使用水、醇、酸作溶剂,其理由是
(5)
 在
在 中完全燃烧放出热量为
中完全燃烧放出热量为 。写出热化学方程式:
。写出热化学方程式:(6)工业上制备亚硫酰氯:
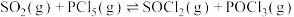
 。下列措施能提高
。下列措施能提高 平衡转化率的是___________(填字母)。
平衡转化率的是___________(填字母)。| A.升高温度 | B.增大压强 | C.加入催化剂 | D.分离 |
您最近一年使用:0次
名校
4 . 重铬酸铵[(NH4)2Cr2O7](M=252 g·mol-1)常用作分析试剂、催化剂及媒染剂等。某化学兴趣小组对重铬酸铵的一些性质及组成进行探究。已知: + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:
(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是______________________ 。
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是___________ 。
②实验过程中,若发现加热温度不够,如何改进?___________ 。
③C装置的作用是___________ 。加热A至恒重,观察到B中固体由白变蓝,D中酚酞溶液不变色,同时测得A中剩余固体1.52 g、B增重0.72 g,另外分解产物中还含有N2,则重铬酸铵受热分解的化学方程式为___________ 。
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:___________ ;酸性增强,对Na2SO3溶液还原性几乎无影响。
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放___________ 溶液;然后向左管中滴加硫酸至pH=2后,测得电压增大了z,若z_____ y(填“>”、“<”或“=”),则证明实验结论不受影响。
 + H2O
+ H2O 2
2 +2H+。回答下列问题:
+2H+。回答下列问题:(1)在试管中加入少量重铬酸铵样品,滴加足量6 mol·L-1 NaOH溶液,振荡、微热。产生的现象是
(2)为探究重铬酸铵的分解产物,按下图连接好装置,在A中加入2.52 g重铬酸铵样品进行实验。

①实验过程中通入N2的主要目的是
②实验过程中,若发现加热温度不够,如何改进?
③C装置的作用是
(3)为探究溶液酸性增强对铬(VI)盐溶液氧化性或Na2SO3溶液还原性的影响,该小组利用下图装置继续实验(已知物质氧化性与还原性强弱差异越大,电压越大)。

a.K闭合时,记录电压。
b.向U型管左侧溶液中滴加硫酸至pH=2后,电压增大了y。
c.继续向U型管右侧溶液中滴加硫酸后,无气体逸出,电压几乎不变。
①上述实验得出结论:
②有同学认为:随着溶液酸性的增强,溶液中O2的氧化性增强也会使电压增大。补做实验:U型管左管中改为盛放
您最近一年使用:0次
解题方法
5 . 某小组研究Cu2+和Fe3+的氧化性,进行如下实验。
实验Ⅰ: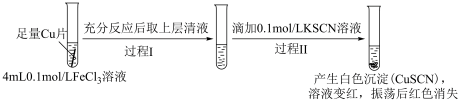
已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是___________ 。
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:___________ 。
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ: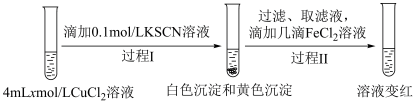
i.
___________ 。
ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为___________ 。
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:
①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若___________ (写出实验现象),
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在答题卡方框中用文字或图示 设计实验方案,并描述相关的实验现象:___________ 。
实验Ⅰ:

已知:1.(SCN)2 是黄色液体,氧化性:I2 < (SCN)2 < Br2。
2.K3[Fe(CN)6]溶液可用于Fe2+的检验,生成蓝色沉淀。
3.Fe3+与SCN-可以形成多种微粒,例如[Fe(SCN)]2+、Fe(SCN)3等溶液显红色。
(1)实验Ⅰ过程Ⅰ中Cu与FeCl3反应的化学方程式是
(2)实验Ⅰ过程Ⅱ中溶液变红,说明产生了Fe3+,分析可能原因。
假设①:Fe2+被Cu2+氧化。
过程Ⅱ发生反应的电极反应式:
a.氧化反应:Fe2+-e-+3SCN-=Fe(SCN)3
b.还原反应:
假设②:Cu2+和SCN-发生反应生成(SCN)2,进而将清液中的Fe2+氧化为Fe3+。
设计实验Ⅱ证实假设。
实验Ⅱ:

i.

ⅱ.实验Ⅱ中过程Ⅱ的离子方程式为
(3)设计实验进一步研究Fe3+能否氧化SCN-。
实验Ⅲ:

①实验Ⅲ中加入K3[Fe(CN)6]溶液后,若
说明在该实验条件下,Fe3+未能氧化SCN-。
②进一步查阅资料发现:Fe3+与SCN-可以发生氧化还原反应。该小组通过实验证明了该反应的发生。请你在
您最近一年使用:0次
6 . 亚硫酸氢钠在染料、造纸制革、化学合成等工业中可用作还原剂。
(一)制备NaHSO3(装置如图所示)。
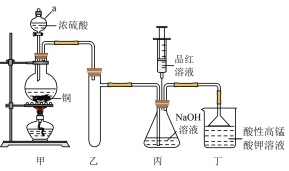
(1)装置丁的作用有①___________ ;②___________ ;③吸收尾气,防止环境污染。
(2)将丙中针筒内品红溶液推进锥形瓶中,若发现___________ ,则说明NaOH已完全转化为NaHSO3。
(二)小组同学欲探究NaHSO3与 的反应,经查阅资料后提出假设,并进行实验验证。
的反应,经查阅资料后提出假设,并进行实验验证。
已知:氯化亚铜(CuCl)是不溶于水的白色沉淀
假设1: 与
与 仅发生双水解反应
仅发生双水解反应
假设2: 可以还原
可以还原
设计实验如下:
①向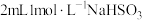 溶液中加入
溶液中加入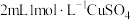 溶液,得到绿色溶液,放置一段时间无明显变化。
溶液,得到绿色溶液,放置一段时间无明显变化。
②向①所得绿色溶液中加入适量NaCl固体,开始无明显变化,30s后有无色气体和白色沉淀生成,同时上层溶液颜色变浅。
(3)实验证实假设___________ 合理,实验①发生的离子方程式为___________ 。
(4)甲、乙同学经查阅资料得知,两电极之间的电势差E越大,反应进行的程度越大,电势差 [其中
[其中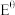 (标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
(标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
①根据上述实验结论,对比甲、乙两实验,写出乙同学实验现象为___________ (写出两条即可)。
②根据相关资料,解释产生上述现象的原因为___________ 。
(一)制备NaHSO3(装置如图所示)。

(1)装置丁的作用有①
(2)将丙中针筒内品红溶液推进锥形瓶中,若发现
(二)小组同学欲探究NaHSO3与
 的反应,经查阅资料后提出假设,并进行实验验证。
的反应,经查阅资料后提出假设,并进行实验验证。已知:氯化亚铜(CuCl)是不溶于水的白色沉淀
假设1:
 与
与 仅发生双水解反应
仅发生双水解反应假设2:
 可以还原
可以还原
设计实验如下:
①向
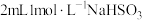 溶液中加入
溶液中加入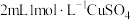 溶液,得到绿色溶液,放置一段时间无明显变化。
溶液,得到绿色溶液,放置一段时间无明显变化。②向①所得绿色溶液中加入适量NaCl固体,开始无明显变化,30s后有无色气体和白色沉淀生成,同时上层溶液颜色变浅。
(3)实验证实假设
(4)甲、乙同学经查阅资料得知,两电极之间的电势差E越大,反应进行的程度越大,电势差
 [其中
[其中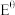 (标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:
(标准电极电势)、R(气体常数)、T(温度)、F(法拉第常数)固定不变],为进一步验证上述结论,设计如下实验:| 编号 | 甲 | 乙 |
| 实验 |  | 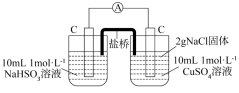 |
②根据相关资料,解释产生上述现象的原因为
您最近一年使用:0次
7 . 下图是飞船和空间站中利用Sabatier反应再生氧气的大体流程。
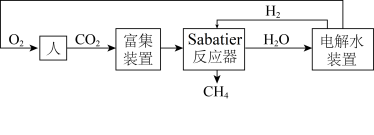
(1)已知:2H2(g)+O2(g) 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
则Sabatier反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=___________ 。
(2)二氧化碳的富集装置如图所示。
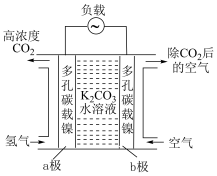
①该富集法采用___________ 原理(填“原电池”或“电解池”)。当a极上消耗1molH2,并保持电解液溶质不变时,b极上除去的CO2在标准状况下的体积为___________ 。
②工作一段时间后,K2CO3溶液的pH___________ (填“变大”“变小”或“不变”)。
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是___________ 。
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是___________ 。
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=___________ (用P0表示)。已知Kp是以分压表示的平衡常数,分压=总压×物质的量分数。
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为___________ (填化学式)。

(1)已知:2H2(g)+O2(g)
 2H2O(g) ∆H=﹣483.6kJ·mol-1
2H2O(g) ∆H=﹣483.6kJ·mol-1CH4(g)+2O2(g)
 CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1
CO2(g)+2H2O(g) ∆H=﹣802.3kJ·mol-1则Sabatier反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的∆H=
CH4(g)+2H2O(g)的∆H=(2)二氧化碳的富集装置如图所示。

①该富集法采用
②工作一段时间后,K2CO3溶液的pH
(3)一定条件下,进行上述Sabatier反应:
①在恒温恒压装置中,下列能说明反应达到平衡状态的是
a.混合气体的密度不再改变 b.混合气体的总质量不再改变
c.混合气体平均摩尔质量不再改变 d.v正(CO2)=2v逆(H2O)
②在Sabatier反应器的前端维持较高温度800K,其目的是
③在温度为T、压强为P0的条件下,按n(CO2)∶n(H2)=1∶4投料进行反应,平衡时CO2的转化率为50%,Kp=
(4)在298K时,几种离子的摩尔电导率如下表。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现O2的再生,从导电性角度选择最适宜的电解质为
| 离子种类 | H+ | OH- |  SO SO | Cl- |  CO CO | K+ | Na+ |
| 摩尔电导率×104(S·m2·mol-1) | 349.82 | 198.0 | 79.8 | 76.34 | 72.0 | 73.52 | 50.11 |
您最近一年使用:0次
名校
8 . 人们应用原电池原理制作了多种电池,以满足不同的需要。以下是几种不同形式的原电池装置,请根据题中提供的信息,填写空格。
(1)某原电池的装置如图1所示。若需将反应
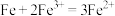 设计成如图1所示的原电池装置,则A(负极)极材料为
设计成如图1所示的原电池装置,则A(负极)极材料为
(2)如图2是一个双液原电池装置图,下列说法正确的是 (填字母)。

A.盐桥中的阴离子向 溶液移动 溶液移动 | B.电子流动方向为Zn→盐桥→Cu |
| C.铜片作电池的正极 | D.该电池比单液原电池的电流更稳定 |
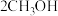 和
和 组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为
组合形成的质子交换膜燃料电池的结构示意图如图3。电池总反应为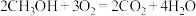 ,则a处充入的是
,则a处充入的是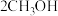 燃料电池消耗的
燃料电池消耗的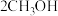 的质量为
的质量为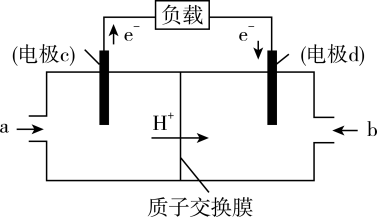
您最近一年使用:0次
2023-07-21更新
|
145次组卷
|
2卷引用:辽宁省本溪市第一中学2023-2024学年高二上学期11月期中考试化学试题
22-23高一下·浙江·期中
解题方法
9 . 化学反应原理在生产、生活中用途广泛。
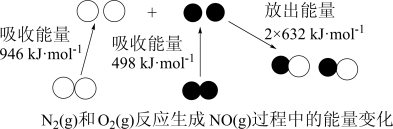
(1)汽车尾气中 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和 完全反应生成
完全反应生成 会
会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①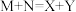 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则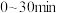 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为_______ 。

(3)实验室模拟热气循环法合成尿素, 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是_______ 。
A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗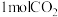 同时生成
同时生成
D. ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1
E.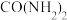 的质量保持不变
的质量保持不变
(4)在硫酸工业中,通过下列反应将 氧化成
氧化成 :
: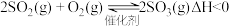 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:
结合表中信息,实际情况下最合理的生产条件为:_______。
(5)锂-氧气电池因其比能量非常高,具有广阔应用前景。下图是一种锂-氧气(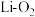 )电池的工作示意图,
)电池的工作示意图,
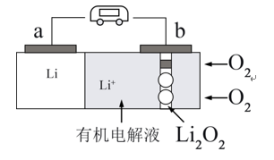
①电池放电时,b为_______ 极(填“正”或“负”),电极反应式为:_______ 。
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:_______ 。
(1)汽车尾气中
 生成过程的能量变化如图所示。
生成过程的能量变化如图所示。 和
和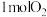 完全反应生成
完全反应生成 会
会 能量。
能量。
(2)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:①
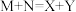 ;②
;② 。反应体系中组分M、Z的浓度随时间变化情况如图所示。则
。反应体系中组分M、Z的浓度随时间变化情况如图所示。则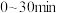 时间段内,Y的平均反应速率为
时间段内,Y的平均反应速率为
(3)实验室模拟热气循环法合成尿素,
 时,将一定量
时,将一定量 与
与 在容积固定的恒温密闭容器中发生反应:
在容积固定的恒温密闭容器中发生反应: ,反应放热。下列情况中,能说明该反应达到平衡的是
,反应放热。下列情况中,能说明该反应达到平衡的是A.反应体系中气体分子的平均摩尔质量保持不变
B.反应体系中气体的密度保持不变
C.反应消耗
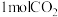 同时生成
同时生成
D.
 ,
, ,
, 三种气体的物质的量比为2∶1∶1
三种气体的物质的量比为2∶1∶1E.
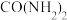 的质量保持不变
的质量保持不变(4)在硫酸工业中,通过下列反应将
 氧化成
氧化成 :
: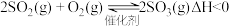 。已知催化剂是
。已知催化剂是 ,在
,在 左右时催化效果最好。下表为不同温度和压强下
左右时催化效果最好。下表为不同温度和压强下 的平衡转化率:
的平衡转化率:| 压强 | 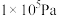 | 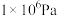 | 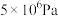 | 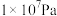 |
 时 时 的平衡转化率 的平衡转化率 | 97.5% | 99.2% | 99.6% | 99.7% |
 时 时 的平衡转化率 的平衡转化率 | 85.6% | 94.9% | 97.7% | 98.3% |
A. , ,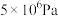 | B. , ,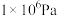 |
C. , ,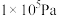 | D. , ,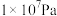 |
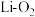 )电池的工作示意图,
)电池的工作示意图,
①电池放电时,b为
②若采用空气作为氧气源,则会发生副反应导致电池性能下降,请写出一个可能的副反应的化学方程式:
您最近一年使用:0次
名校
10 . 某化学兴趣小组为了探索 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似,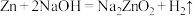 。回答下列问题:
。回答下列问题:
(1)实验1:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
①正极的电极反应式为___________ 。
②每转移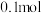 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为___________ g。
(2)实验2:电极材料为 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。
由实验1和实验2可知, 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为___________ 。
(3)实验3:电极材料为石墨和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
①电池工作一段时间后,电解质溶液的 将
将___________ (填“变大”、“变小”或“不变”)。
②石墨电极上发生___________ (填“氧化”或“还原”)反应。
(4)实验4:电极材料为 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。
①负极的电极反应式为___________ 。
②外电路中电子的流动方向为___________ 。
 电极在原电池中的作用,设计并进行了以下一系列实验。已知:
电极在原电池中的作用,设计并进行了以下一系列实验。已知: 与
与 的化学性质基本相似,
的化学性质基本相似,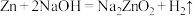 。回答下列问题:
。回答下列问题:(1)实验1:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。①正极的电极反应式为
②每转移
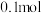 电子,此时负极材料减少的质量为
电子,此时负极材料减少的质量为(2)实验2:电极材料为
 和
和 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向 。
。由实验1和实验2可知,
 三种金属活动性由强到弱的顺序为
三种金属活动性由强到弱的顺序为(3)实验3:电极材料为石墨和
 ,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。
,电解质溶液为稀盐酸,该电池工作时,电流表指针偏向石墨。①电池工作一段时间后,电解质溶液的
 将
将②石墨电极上发生
(4)实验4:电极材料为
 和
和 ,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向
,电解质溶液为氢氧化钠溶液,该电池工作时,电流表指针偏向 。
。①负极的电极反应式为
②外电路中电子的流动方向为
您最近一年使用:0次



