名校
解题方法
1 . 某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制___ 、___ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为___ 。
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用___ 。
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
您最近一年使用:0次
2 . 填空题
(1)浓硝酸久置显黄色的原因(用化学方程式回答)___________
(2)氢氟酸腐蚀玻璃的原因(用化学方程式回答)___________
(3)请用实验方法证明某无色晶体是
___________
(4)下面三个化学方程式能不能设计成原电池
a.
b.
c.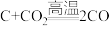
请回答:若不能,说明理由:___________ ,如果能,请画出设计的简单原电池的示意图,并标出正、负极,写出电极反应式。
(1)浓硝酸久置显黄色的原因(用化学方程式回答)
(2)氢氟酸腐蚀玻璃的原因(用化学方程式回答)
(3)请用实验方法证明某无色晶体是

(4)下面三个化学方程式能不能设计成原电池
a.

b.

c.
请回答:若不能,说明理由:
您最近一年使用:0次
3 . 电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____ 。
(2)检验另一电极产物的操作及现象是_____ 。
(3)负极的电极反应式为_____ 。
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是____ 。
(5)阳极区 pH 降低的原因是____ 。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____ 。(写出一条即可)
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
| 装置 | 实验现象 |
 1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成
(2)检验另一电极产物的操作及现象是
(3)负极的电极反应式为
II. 工业上用 Na2SO4溶液吸收工业烟气中的低浓度 SO2形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图

阴极区和阳极区的pH 随时间的变化关系如下图:

(4)阳极反应的电极反应物是
(5)阳极区 pH 降低的原因是
(6) 结合电极反应式,说明阴极区 pH 升高的原因
您最近一年使用:0次
解题方法
4 . 某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:
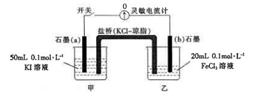
实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____ (填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________ 。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________ (填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________ 。
(4)要证明2Fe3++2I- 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________ (填序号)。

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向
(2)经步骤①后,乙烧杯溶液中新增金属阳离子
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式
(4)要证明2Fe3++2I-
 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是
您最近一年使用:0次
2018-03-06更新
|
332次组卷
|
2卷引用:浙江省金华十校2017-2018学年高二上学期期末调研考试化学试题
2020·山东·模拟预测
5 . 2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

 xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
| A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子 |
| B.放电时,负极反应为:LiFePO4−xe−=Li1-xFePO4+xLi+ |
| C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入 |
| D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻4.0 g |
您最近一年使用:0次
名校
解题方法
6 . I.能源是现代文明的原动力,化学电池在生产生活中有着广泛的应用。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是_____ (填序号)。
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
(2)放电时负极反应为_____ 。
(3)放电时正极附近溶液的碱性_____ (填“增强”或“减弱”或“不变”)。
(4)放电时每转移_____ mol电子,正极有1molK2FeO4被还原。
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是_____ 。
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。_____ 。
(7)a膜为_____ (填“阳离子”或“阴离子”,下同)交换膜,b膜为_____ 交换膜。
(1)根据构成原电池的本质判断,下列反应可以设计成原电池的是
| A.CaO(s)+H2O(l)=Ca(OH)2(aq) | B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) |
| C.2CO(g)+O2(g)=2CO2(g) | D.Fe(s)+2FeCl3(aq)=3FeCl2(aq) |
Ⅱ.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。(2)放电时负极反应为
(3)放电时正极附近溶液的碱性
(4)放电时每转移
Ⅲ.回答下列问题:
(5)科学家研发出一种有利于“碳中和”的新电池系统,通过二氧化碳溶于水触发电化学反应,其工作原理如图所示(钠超离子导体只允许Na+通过)。系统工作时,下列有关说法中错误的是
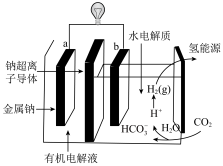
| A.Na+将从a极移动到b极 |
| B.该电池的电解液可以换成更易导电的饱和NaCl溶液 |
C.b极区可能会发生Na++HCO =NaHCO3↓ =NaHCO3↓ |
| D.b极区每生成1molH2转移2mol电子 |
Ⅳ.中国科学技术大学开发了一种高性能的水系锰基锌电池。其工作原理如图所示,已知该装置工作一段时间后,K2SO4溶液的浓度增大。

(7)a膜为
您最近一年使用:0次
2023-04-26更新
|
559次组卷
|
2卷引用:天津市第一中学2022-2023学年高一下学期期中考试化学试题
解题方法
7 . 电化学技术在处理污染气体领域的应用广泛。
(1)利用反应 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。

①A电极的电极反应式为___________ 。
②下列关于该电池的说法正确的是___________ 。
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的 不变
不变
D.当有 被处理时,转移电子物质的量为
被处理时,转移电子物质的量为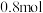
(2)以含 废气为原料,用电化学方法制取硫酸。装置如图。
废气为原料,用电化学方法制取硫酸。装置如图。

写出负极电极反应式___________ 。若发电厂利用上述装置处理含 废气,电池输出电压为
废气,电池输出电压为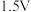 ,每天处理废气约为
,每天处理废气约为 (标准状况),废气中
(标准状况),废气中 体积分数为2.24%。则该电池每天提供
体积分数为2.24%。则该电池每天提供___________  电能。(
电能。( 的电量为
的电量为 )
)
(1)利用反应
 构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
构成电池的方法,既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
①A电极的电极反应式为
②下列关于该电池的说法正确的是
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一段时间,溶液的
 不变
不变D.当有
 被处理时,转移电子物质的量为
被处理时,转移电子物质的量为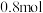
(2)以含
 废气为原料,用电化学方法制取硫酸。装置如图。
废气为原料,用电化学方法制取硫酸。装置如图。
写出负极电极反应式
 废气,电池输出电压为
废气,电池输出电压为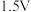 ,每天处理废气约为
,每天处理废气约为 (标准状况),废气中
(标准状况),废气中 体积分数为2.24%。则该电池每天提供
体积分数为2.24%。则该电池每天提供 电能。(
电能。( 的电量为
的电量为 )
)
您最近一年使用:0次
解题方法
8 . I.一种利用电化学原理治污的装置如下图,其反应原理是6NO2+8NH3=7N2+12H2O
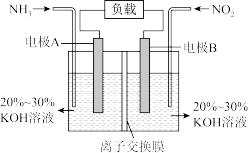
(1)A电极的电极反应式为___________ 。
(2)下列关于该电池说法正确的是___________(填序号)。
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。
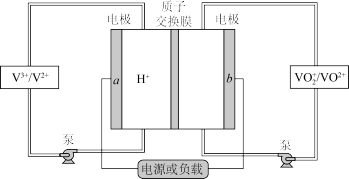
(3)电极b为___________ 极(填“正”或“负”)。充电时,该电极的反应为___________ 。
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
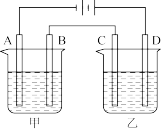
①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗___________ mol H+。
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为___________ mol。
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上___________ (填“嵌入”或“迁出”)。

(1)A电极的电极反应式为
(2)下列关于该电池说法正确的是___________(填序号)。
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电池工作一段时间,溶液的pH不变 |
| D.当有44.8 LNO2被处理时,转移电子的物质的量为8 mol |
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。

(3)电极b为
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上
您最近一年使用:0次
9 . 工业制硝酸的主要反应为:4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=_____ 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
①反应在第2min到第4min时,O2的平均反应速率为_____ 。
②反应在第6min时改变了条件,改变的条件可能是_____ (填序号).
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是_____ (填序号).
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
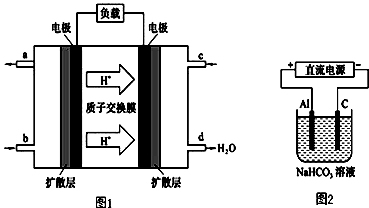
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为_____ 。
②该电池负极的电极反应式为:_____ 。
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:_____ (用相关的离子方程式表示)。
(1)已知氢气的燃烧热为△H=﹣285.8kJ/mol.
N2(g)+3H2(g)═2NH3(g)△H=﹣92.4kJ/mol;
N2(g)+O2(g)═2NO(g)△H=+180.6kJ/mol.
则上述工业制硝酸的主要反应的△H=
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如表:
| 浓度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
①反应在第2min到第4min时,O2的平均反应速率为
②反应在第6min时改变了条件,改变的条件可能是
A.使用催化剂 B.升高温度 C.减小压强 D.增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是
A.单位时间内生成n mol NO的同时,生成n mol NH3
B.条件一定,混合气体的平均相对分子质量不再变化
C.百分含量w(NH3)=w(NO)
D.反应速率v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH2=CH2﹣O2燃料电池的工作原理如图1所示.
①该电池工作时,b口通入的物质为
②该电池负极的电极反应式为:
③以此电池作电源,在实验室中模拟铝制品表面“钝化”处理(装置如图2所示)的过程中,发现阳极周围变浑浊并有气泡产生,其原因可能是:

您最近一年使用:0次
2016-01-14更新
|
138次组卷
|
2卷引用:2016届宁夏银川二中高三上学期统考理综化学试卷



