1 . 为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________ 。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为___________ ,正极反应为___________ 。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为
(2)FeCl3溶液常用于腐蚀印刷电路铜板,若将此反应设计成原电池,则负极所用电极材料为
您最近一年使用:0次
2021高三·全国·专题练习
名校
解题方法
2 . 按要求完成下列问题。
(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:

①HS-在硫氧化菌作用下转化为 的电极反应式是
的电极反应式是_______ 。
②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是_______ 。
(2)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向_______ (填“负极”或“正极”)移动。
②负极反应式为_______ 。
③电路中每转移0.2mol电子,理论上生成_______ gPb。
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如下图所示。

①a电极的电极反应式是_______ ;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_______ 。
(1)微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如下图所示:

①HS-在硫氧化菌作用下转化为
 的电极反应式是
的电极反应式是②若维持该微生物电池中两种细菌的存在,则电池可以持续供电,原因是
(2)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。

①放电过程中,Li+向
②负极反应式为
③电路中每转移0.2mol电子,理论上生成
(3)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如下图所示。

①a电极的电极反应式是
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是
您最近一年使用:0次
名校
解题方法
3 . 人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥者越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为: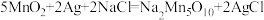 。
。
①该电池的负极反应式是___________ ;
②在电池中,Na+不断移动到“水”电池的___________ 极(填“正”或“负”);
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图乙所示,两电极区间用允许K+、H+通过的半透膜隔开。
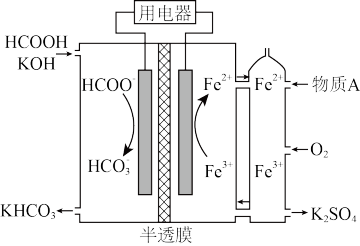
①电池负极电极反应式为___________ ;放电过程中需补充的物质A为___________ (填化学式)。
②电池工作时,当电池右侧电极区通入标况下的O211.2L时,负极区消耗燃料HCOOH___________ g。
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:___________ 。
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:
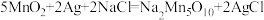 。
。①该电池的负极反应式是
②在电池中,Na+不断移动到“水”电池的
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图乙所示,两电极区间用允许K+、H+通过的半透膜隔开。

①电池负极电极反应式为
②电池工作时,当电池右侧电极区通入标况下的O211.2L时,负极区消耗燃料HCOOH
(3)Ag2O2是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
您最近一年使用:0次
4 . 我国科学家最近发明了一种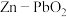 电池,电解质为
电池,电解质为 、
、 和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
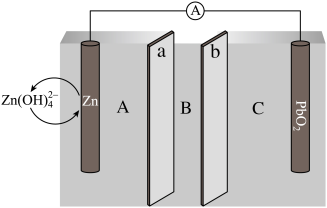
回答下列问题:
(1)电池中,Zn为_______ 极,B区域的电解质为_______ (填“ ”“
”“ ”或“KOH”)。
”或“KOH”)。
(2)电池反应的离子方程式为_______ 。
(3)阳离子交换膜为图中的_______ (填“a”或“b”)膜。
 电池,电解质为
电池,电解质为 、
、 和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如下:
回答下列问题:
(1)电池中,Zn为
 ”“
”“ ”或“KOH”)。
”或“KOH”)。(2)电池反应的离子方程式为
(3)阳离子交换膜为图中的
您最近一年使用:0次
2021-07-31更新
|
914次组卷
|
5卷引用:选择性必修1(SJ)专题1第二单元课时2 化学电源
选择性必修1(SJ)专题1第二单元课时2 化学电源(已下线)4.1.2 化学电源(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)专题11 电化学-2022年高考化学二轮复习重点专题常考点突破练(已下线)第四章 化学反应与电能(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)1.2.2化学电源 课中
2021高三·全国·专题练习
5 . 二氧化硫在生产和生活中有着广泛的用途。
(1)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为_______ ;吸收后的浓溶液可用图1的装置再生循环脱硫,并制得硫酸,电极a的电极反应为_______ ,乙是_______ 。


(2)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是_______ ,c电极是__ 极,移动的离子及方向是_______ 。
(1)用足量NaOH溶液吸收尾气中的SO2,反应的离子方程式为


(2)可设计二氧化硫空气质子交换膜燃料电池处理尾气中的二氧化硫,原理如图2所示。其能量转化的主要形式是
您最近一年使用:0次
解题方法
6 . 如图所示,是原电池的装置图。请回答:

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为___________ 。
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为___________ , B 极电极反应式为___________ 。
(3)若 C 为 CuCl2溶液,Zn 是___________ 极(填正极或负极),Cu 极发生___________ 反应(填氧化或还原),Cu 极电极反应为___________ 。
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为___________ ,若线路中转移 2 mol 电子,则上述 CH3OH 燃料电池,消耗的 O2 在标准状况下的体积为___________ L。

(1)若溶液C 为稀H2SO4溶液,电流表指针发生偏转,B 电极材料为Fe 且作负极,则 A 电极上发生的电极反应为
(2)若需将反应 Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则 A 极(负极)材料为
(3)若 C 为 CuCl2溶液,Zn 是
(4)CO 与 H2反应还可制备 CH3OH,CH3OH 可作为燃料使用,用 CH3OH 和 O2组合形成的质子交换膜燃料电池的结构示意图如下:

电池总反应为 2CH3OH+3O2=2CO2+4H2O,则电极 d 反应式为
您最近一年使用:0次
名校
解题方法
7 . (1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,并回答下列问题:可用___________ 作正极材料,电解质溶液是___________ 正极反应的电极方程式为___________
(2)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的___________ 极,OH-向___________ (填“正”或“负”)极作定向移动,Y极的电极反应式为___________ 。

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应式为2PbSO4+2H2O Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
Pb+PbO2+2H2SO4.铅蓄电池放电时正极是___________ (填化学式),该电极质量___________ (填“增加”或“减少”)。放电过程中外电路中转移3 mol电子,消耗硫酸___________ mol
(2)下图为氢氧燃料电池的构造示意图,由此判断X极为电池的

(3)铅蓄电池是常见的化学电源之一,其充电、放电的总反应式为2PbSO4+2H2O
 Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
Pb+PbO2+2H2SO4.铅蓄电池放电时正极是
您最近一年使用:0次
名校
8 . 最近报道了一种新型可逆电池。该电池的负极为金属铝,正极为(Cn [ AlCl4]),式中Cn表示石墨;电解质为烃基取代咪唑阳离子(R+)和AlCl4阴离子组成的离子液体。电池放电时,在负极附近形成双核配合物。充放电过程中离子液体中的阳离子始终不变。
(1)写出电池放电时,正极、负极以及电池反应方程式________ 。
(2)该电池所用石墨按如下方法制得:甲烷在大量氢气存在下热解,所得碳沉积在泡沫状镍模板表面。写出甲烷热解反应的方程式_____ 。采用泡沫状镍的作用何在,简述理由_____ 。
(3)写出除去制得石墨后的镍的反应方程式______ 。
(4)该电池的电解质是将无水三氯化铝溶入烃代咪唑氯化物离子液体中制得,写出方程式_____ 。
(1)写出电池放电时,正极、负极以及电池反应方程式
(2)该电池所用石墨按如下方法制得:甲烷在大量氢气存在下热解,所得碳沉积在泡沫状镍模板表面。写出甲烷热解反应的方程式
(3)写出除去制得石墨后的镍的反应方程式
(4)该电池的电解质是将无水三氯化铝溶入烃代咪唑氯化物离子液体中制得,写出方程式
您最近一年使用:0次
2021-07-02更新
|
82次组卷
|
3卷引用:第29届(2015年8月30日)中国化学奥林匹克(初赛)试题(试题解析)
9 . (1)为防止碳素钢菜刀生锈,使用后特别是切过咸菜后,应采取的简易措施是___________
(2)铁与硫可以在一定条件下发生化合反应:Fe+S=FeS。该反应属于放热反应,不需要催化剂。现有块状的铁和硫磺,欲进行反应实验,,反应前宜采取的措施是___________ ,目的是___________ 。
(2)铁与硫可以在一定条件下发生化合反应:Fe+S=FeS。该反应属于放热反应,不需要催化剂。现有块状的铁和硫磺,欲进行反应实验,,反应前宜采取的措施是
您最近一年使用:0次
名校
解题方法
10 . 某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制___ 、___ 相同;若选用一种盐溶液验证三种金属的活泼性,该试剂为___ 。
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用___ 。
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用
A.0.5mol·L-1氯化亚铁溶液
B.0.5mol·L-1氯化铜溶液
C.0.5mol·L-1盐酸
D.0.5mol·L-1氯化亚铁和0.5mol·L-1氯化铜混合溶液
您最近一年使用:0次



