1 . 用CO2制备CH3OH可实现CO2的能源化利用,同时甲醇也是重要的化工原料,发展前景广阔。制备CH3OH反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
(1)温度为523K时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ。反应的热化学方程式为___________ 。
(2)该反应的化学平衡常数表达式K=___________ 。
在实验室模拟上述反应。一定温度下,向体积为1L的恒容密闭容器中充入3mol 和6moH2,加入合适的催化剂进行反应。已知该温度下反应的化学平衡常数值为K=1/40某时刻测得c(CH3OH)=1mo/L,此时反应___________ (填“已经达到“或未达到”)化学平衡状态。
(3)工业上用CO2制备CH3OH的过程中存在以下副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
①不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2。
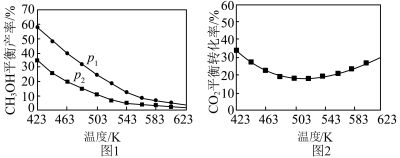
i.图1中,压强p1___________ p2(填“>”“=”或“<”),推断的依据是___________ 。
ii.图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是___________ 。
②实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3。图3中523K时的CH3OH产率最大,可能的原因是___________ (字母序号)。
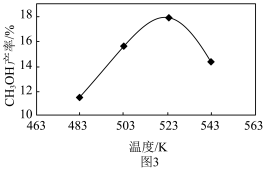
a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523K时催化剂的活性最强
③某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
【注】甲醇选择性:转化的CO2中生成甲醇的百分比
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是______ 。
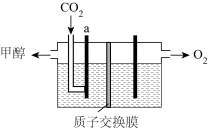
(4)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a是___________ 极(填“阴”或“阳”)生成甲醇的电极反应式是___________ 。
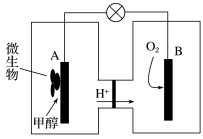
(5)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示,A电极反应是___________ ,B电极反应是___________ 。
 CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。(1)温度为523K时,测得上述反应中生成8.0gCH3OH(g)放出的热量为12.3kJ。反应的热化学方程式为
(2)该反应的化学平衡常数表达式K=
在实验室模拟上述反应。一定温度下,向体积为1L的恒容密闭容器中充入3mol 和6moH2,加入合适的催化剂进行反应。已知该温度下反应的化学平衡常数值为K=1/40某时刻测得c(CH3OH)=1mo/L,此时反应
(3)工业上用CO2制备CH3OH的过程中存在以下副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
CO(g)+H2O(g) △H=+41.2kJ/mol,将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。①不同温度和压强下,CH3OH平衡产率和CO2平衡转化率分别如图1、图2。

i.图1中,压强p1
ii.图2中,压强为p2,温度高于503K后,CO2平衡转化率随温度升高而增大的原因是
②实际生产中,测得压强为p3时,相同时间内不同温度下的CH3OH产率如图3。图3中523K时的CH3OH产率最大,可能的原因是

a.此条件下主反应限度最大 b.此条件下主反应速率最快 c.523K时催化剂的活性最强
③某实验控制压强一定,CO2和H2初始投料比一定,按一定流速通过催化剂乙,经过相同时间测得如下实验数据(反应未达到平衡状态):
| T(K) | CO2实际转化率(%) | 甲醇选择性(%)【注】 |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
表中实验数据表明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是
(4)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a是

(5)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如图所示,A电极反应是

您最近一年使用:0次
名校
解题方法
2 . 甲醇(CH3OH)的合成与应用具有广阔的发展前景。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为__________________ 。
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线_______ 是合成反应器出口样品的温度。

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是______________ 。
(3)图为甲醇燃料电池的示意图。
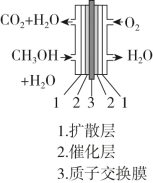
负极的电极反应式为______________ ;
正极的电极反应式为_______________ 。
合成甲醇的部分工艺流程如下:原料气→预热装置→合成反应器→甲醇
(1)甲烷与水蒸气反应制备合成甲醇的原料气CO、CO2和H2。
CH4(g)+H2O(g)=CO(g)+3H2(g) ∆H =+206.2 kJ·mol-1
CO(g) + H2O(g) =CO2(g) + H2(g) ∆H =˗41.0 kJ·mol-1
甲烷与水蒸气反应生成CO2和H2的热化学方程式为
(2)在催化剂的作用下,200~300℃时,合成反应器内发生反应:
ⅰ.CO(g)+2H2(g)⇌CH3OH(g) ∆H<0
ⅱ.CO2(g)+3H2(g)⇌CH3OH(g) + H2O(g) ∆H<0
①一段时间内,记录合成反应器出、入口样品的温度,数据如图所示。曲线

②在催化剂的作用下,200~300℃时,合成反应器中有少量的副反应,会生成二甲醚(CH3OCH3)、甲酸甲酯等。
CO和H2生成二甲醚的化学方程式是
(3)图为甲醇燃料电池的示意图。

负极的电极反应式为
正极的电极反应式为
您最近一年使用:0次
2020-10-14更新
|
153次组卷
|
2卷引用:北京市北大附中实验学校2020-2021学年高二上学期10月月考化学试题
名校
解题方法
3 . 如图所示是原电池的装置图。请回答:

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为___ ;反应进行一段时间后溶液酸性将__ (填“增强”“减弱”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为___ ,B(负极)极材料为__ ,溶液C为___ 。
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
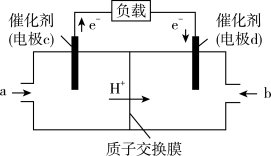
电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是__ (填“正极”或“负极”),c电极的反应方程式为__ 。若线路中转移1mol电子,则上述CH3OH燃料电池消耗的O2在标准状况下的体积为__ L。

(1)若C为稀H2SO4,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示的原电池装置,则A(正极)极材料为
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:

电池总反应为2CH3OH+3O2=2CO2+4H2O,则d电极是
您最近一年使用:0次
2020-06-23更新
|
561次组卷
|
3卷引用:北京市首都师范大学附属中学2019-2020学年高一下学期结业考试(期末)化学试题
解题方法
4 . 煤的气化技术发展较早,近几年来煤的气化技术更多的倾向于用水煤浆与粉煤为原料的加压气化技术。煤的气化的流程示意图如下:
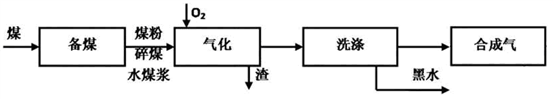
(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g) CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol
②2CO(g)+O2(g) 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
写出利用水煤浆生产水煤气的热化学方程式___________________ 。
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示: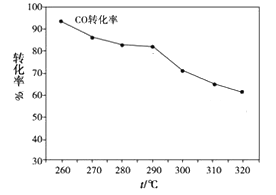
①合成二甲醚的化学方程式为___________________________
②其中CO的转化率随温度的升高而降低的原因_________________ 。
③有利于该反应充分进行的条件是______________ (填字母)
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了________ 因素
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
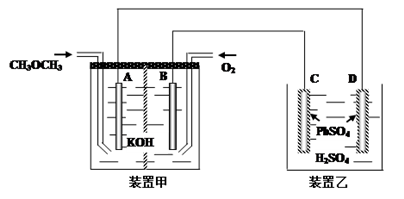
① 写出甲装置中B极的电极反应____________________________
② 写出乙装置中D极的电极反应式___________________________
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为____ mol

(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g)
 CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol②2CO(g)+O2(g)
 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol③2H2(g)+O2(g)
 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol写出利用水煤浆生产水煤气的热化学方程式
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示:

①合成二甲醚的化学方程式为
②其中CO的转化率随温度的升高而降低的原因
③有利于该反应充分进行的条件是
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。

① 写出甲装置中B极的电极反应
② 写出乙装置中D极的电极反应式
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为
您最近一年使用:0次



