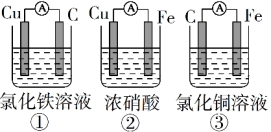
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH−向B 电极定向移动,则
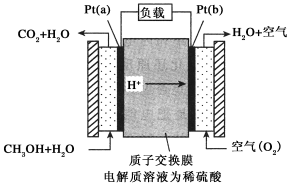
请回答下列问题:
①Pt(a)电极反应式为
②如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有
(2)某科研单位利用电化学原理用SO2来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
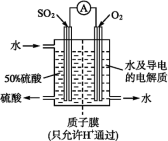
①通入SO2的电极,其电极反应式为
②电解质溶液中的H+通过质子膜
③电池总反应式为
3 . CH3OH是一种重要的化工原料。工业上常以CO和H2的混合气体为原料制备甲醇,其反应方程式为CO+2H2⇌CH3OH。
(1)一定条件下向2 L的密闭容器中通入一定量的CO和H2使其发生上述反应,n(CO)随时间的变化如下表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(CO)/mol | 1.0 | 0.8 | 0.5 | 0.25 | 0.20 | 0.20 |
①平均反应速率最大的时间段:
②从反应开始到3 min末,氢气的平均反应速率v(H2)=
③能够判断该反应达到平衡的是
a.v逆(CO)=2v正(H2)
b.CO、H2和CH3OH三种物质的浓度相等
c.CH3OH分解的速率和CH3OH生成的速率相等
d.相同时间内消耗1molCO,同时消耗1molCH3OH
④工业上用CO和H2为原料制备甲醇的过程中,会有副产物二甲醚(CH3OCH3)生成,写出该反应的化学方程式:
(2)甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气、KOH溶液构成,电池总反应为2CH3OH+3O2+4OH-=2 + 6H2O,其装置图下图所示。
+ 6H2O,其装置图下图所示。

①电极a为电池的
②电极b的电极反应式:
③电极C的电极反应式:



