解题方法
1 . 按要求写出下列离子方程式
(1)(NH4)2SO4水解:_______ 。
(2)NaHCO3水解:_______ 。
(3)Ag2CrO4沉淀溶解平衡:_______ 。
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+ O2=H2O。则负极反应式:
O2=H2O。则负极反应式:_______ 、正极反应式_______ 。
(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:_______ 。
②简要说明白色固体转化为黑色固体的原因:_______ 。
(1)(NH4)2SO4水解:
(2)NaHCO3水解:
(3)Ag2CrO4沉淀溶解平衡:
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+
 O2=H2O。则负极反应式:
O2=H2O。则负极反应式:(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:
②简要说明白色固体转化为黑色固体的原因:
您最近一年使用:0次
解题方法
2 . 人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。请根据题中提供的信息,回答下列问题:
(1)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是___________ 。
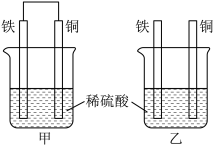
A.甲、乙均为化学能转变为电能的装置
B.甲、乙中铜片上均没有明显现象
C.甲、乙中铁片质量均减少
D.甲、乙两烧杯中 均减小
均减小
②在相同时间内,两烧杯中产生气泡的速度:甲___________ 乙(填“>”、“<”或“=”、“无法判断”)。
③请写出甲、乙中构成原电池的正极电极反应式:___________ 。电池工作时,溶液中 向
向___________ 极(填“铜极”或“铁极”)移动。当构成原电池的溶液质量增重27g时,电极上转移电子数目为___________ 。
④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为___________ 。
(2)燃料电池是目前电池研究的热点之一,某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。

①正极是___________ (填“a”或“b”),a极发生的电极反应式是___________ 。
②将上图 改成甲烷,电解质溶液改成
改成甲烷,电解质溶液改成 溶液。通甲烷电极反应式为
溶液。通甲烷电极反应式为___________ 。
(3)用燃料电池做电源,用惰性电极电解饱和食盐水,电解总反应方程式为___________ 。
(1)将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是

A.甲、乙均为化学能转变为电能的装置
B.甲、乙中铜片上均没有明显现象
C.甲、乙中铁片质量均减少
D.甲、乙两烧杯中
 均减小
均减小②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出甲、乙中构成原电池的正极电极反应式:
 向
向④若将甲中的稀硫酸换为浓硝酸,则电池总反应的离子方程式为
(2)燃料电池是目前电池研究的热点之一,某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。

①正极是
②将上图
 改成甲烷,电解质溶液改成
改成甲烷,电解质溶液改成 溶液。通甲烷电极反应式为
溶液。通甲烷电极反应式为(3)用燃料电池做电源,用惰性电极电解饱和食盐水,电解总反应方程式为
您最近一年使用:0次
3 . 北京冬奥会赛区内将使用氢燃料清洁能源车辆,就是利用原电池原理提供清洁电能,回答下面问题:
(1)某氢氧燃料电池工作示意图如图1。

①电极a是_______ (填“正极”“负极”“阳极”或“阴极”),电极a发生的电极反应是_______ 。
②电解质KOH溶液中K+向_______ 电极移动(填“a”或“b”)。
(2)利用图1中的原电池电解饱和食盐水,可以有效的利用海水资源,原理如图:
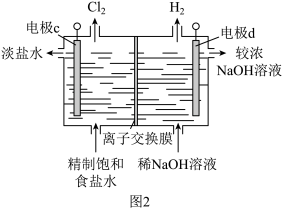
①电极d应连接图1装置的_______ 电极(填“a”或“b”),离子交换膜是_______ (填“阴离子交换膜”或“阳离子交换膜”)。
②写出电极c的电极反应_______ 。
③写出电解饱和食盐水的离子方程式_______ 。
(3)将铁钉的下半部分分别镀上铜和锌,放入培养皿中,加入饱和食盐水溶液,再各滴入几滴酚酞溶液和K3[Fe(CN)6]溶液。装置如图3:
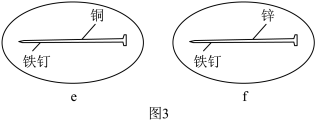
①在铁钉下半部分镀上铜的装置中,阳极材料是_______ (填化学式)。
②e装置中出现蓝色沉淀,铜电极发生的电极反应是_______ 。
③f装置中可能出现的现象是_______ 。
(1)某氢氧燃料电池工作示意图如图1。

①电极a是
②电解质KOH溶液中K+向
(2)利用图1中的原电池电解饱和食盐水,可以有效的利用海水资源,原理如图:

①电极d应连接图1装置的
②写出电极c的电极反应
③写出电解饱和食盐水的离子方程式
(3)将铁钉的下半部分分别镀上铜和锌,放入培养皿中,加入饱和食盐水溶液,再各滴入几滴酚酞溶液和K3[Fe(CN)6]溶液。装置如图3:

①在铁钉下半部分镀上铜的装置中,阳极材料是
②e装置中出现蓝色沉淀,铜电极发生的电极反应是
③f装置中可能出现的现象是
您最近一年使用:0次
名校
4 . 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
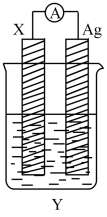
(1)电极X的材料是____ ;电解质溶液Y是____ 。
(2)X电极发生的电极反应式为____ ;Ag电极上发生的反应类型为____ 。
(3)外电路中的电子是从____ 电极流向____ 电极。Cu2+向___ (填“正极”或“负极”)移动。
(4)当Ag电极增重21.6g时,则X电极的质量减少____ 。
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O;B极:O2+4e-=2O2-。则A极是电池的____ 极;当B极参加反应的气体为112mL(标准状况),电路中转移电子的个数约为____ ,该电池的总反应为____ 。

(1)电极X的材料是
(2)X电极发生的电极反应式为
(3)外电路中的电子是从
(4)当Ag电极增重21.6g时,则X电极的质量减少
(5)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:H2+O2--2e-=H2O;B极:O2+4e-=2O2-。则A极是电池的
您最近一年使用:0次
解题方法
5 . 实验室中,学生利用下图装置制作一个简单燃料电池。步骤如下:

①检验装置气密性后向U形管中注入适量的6 mol·L-1稀H2SO4溶液,至接近橡胶塞底部。
②接通学生电源K1,观察实验现象,当一端玻璃导管内的液柱接近溢出时,切断学生电源K1。
③将石英钟内的干电池取出,用导线与石英钟的正负极相连,接入装置中。接通学生电源K2,观察石英钟指针。
回答下列问题:
(1)接通学生电源K1,在右侧石墨棒表面观察到_______ 。
(2)观察到左侧的玻璃导管内的液柱先接近溢出,说明左侧石墨棒所连的是学生电源的_______ (填“正极”或“负极”),该石墨表面的电极方程式是_______ 。
(3)用导线与石英钟的正负极相连接入装置时,石英钟的正极应与_______ (填“左”或“右”)侧的石墨棒连接的导线相连。
(4)出现_______ 的现象,证明该燃料电池制作成功。燃料电池正极的电极方程式是_______ 。

①检验装置气密性后向U形管中注入适量的6 mol·L-1稀H2SO4溶液,至接近橡胶塞底部。
②接通学生电源K1,观察实验现象,当一端玻璃导管内的液柱接近溢出时,切断学生电源K1。
③将石英钟内的干电池取出,用导线与石英钟的正负极相连,接入装置中。接通学生电源K2,观察石英钟指针。
回答下列问题:
(1)接通学生电源K1,在右侧石墨棒表面观察到
(2)观察到左侧的玻璃导管内的液柱先接近溢出,说明左侧石墨棒所连的是学生电源的
(3)用导线与石英钟的正负极相连接入装置时,石英钟的正极应与
(4)出现
您最近一年使用:0次
名校
6 . 如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
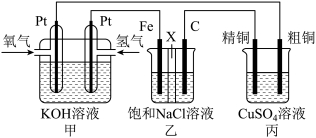
根据要求回答相关问题:
(1)通入氧气的电极为___________ (填“正极”或“负极”),负极的电极反应式为___________ 。
(2)铁电极为___________ (填“阳极”或“阴极”),石墨电极(C)的电极反应式为___________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将___________ (填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为___________ ;丙装置中阴极析出铜的质量为___________ 。
(5)利用图制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的___________ 极;该发生器中反应的总离子方程式为___________

(6)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。
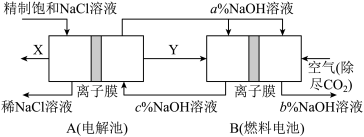
分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为___________ 。

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
(5)利用图制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分,则c为电源的

(6)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(其中的电极未标出,所用的离子膜都只允许阳离子通过)。

分析图可知,氢氧化钠的质量分数为a%、b%、c%,由大到小的顺序为
您最近一年使用:0次
名校
7 . 氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出:
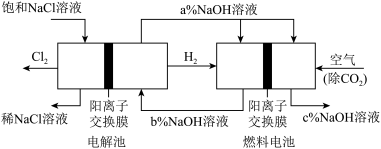
回答下列有关问题:
(1)电解池的阴极反应式为___________ 。
(2)通入空气的电极的电极反应式为___________ ,燃料电池中阳离子的移动方向___________ (“从左向右”或“从右向左”)。
(3)电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为___________ 。
(4)a、b、c的大小关系为:___________ 。

回答下列有关问题:
(1)电解池的阴极反应式为
(2)通入空气的电极的电极反应式为
(3)电解池中产生2molCl2,理论上燃料电池中消耗O2的物质的量为
(4)a、b、c的大小关系为:
您最近一年使用:0次
2021-08-31更新
|
338次组卷
|
2卷引用:河北省衡水市第十四中学2021-2022学年高二上学期一调考试化学试题
名校
解题方法
8 . 美国“阿波罗”宇宙飞船中使用的氢氧燃料电池,其构造如图所示:
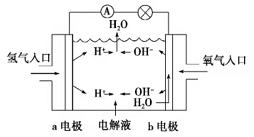
(1)KOH作电解质,其电极总反应为2H2+O2=2H2O,则负极通入的是________ ,电极反应式为______ ;正极通入的是____ ,电极反应式为______ ;
(2)如把KOH溶液改为稀硫酸,则负极电极反应式为:_____ ,正极电极反应式为:______ 。

(1)KOH作电解质,其电极总反应为2H2+O2=2H2O,则负极通入的是
(2)如把KOH溶液改为稀硫酸,则负极电极反应式为:
您最近一年使用:0次
2021-01-20更新
|
826次组卷
|
3卷引用:河北省顺平县中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
9 . 通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极反应的物质为____ ,正极反应的物质为______ ,酸式电池的电极反应:
负极:__________________________________ ,正极:___________________________ 。
(2)在碱式介质中,碱式电池的电极反应:
负极:__________________________________ ,正极:___________________________ 。
电解质溶液pH的变化_______________ (填“变大”,“变小”,“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________ 。
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4) 铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4 2PbSO4+2H2O。根据上述情况判断:
2PbSO4+2H2O。根据上述情况判断:
I.铅蓄电池的负极材料是________ ;工作时,正极反应为_________________ ;
II.工作时,电解质溶液的pH________ (填“增大”、“减小”或“不变”);
III.工作时,电解质溶液中的阴离子移向_______ 极;电流方向从______ 极流向______ 极;
IV. 充电时,铅蓄电池的负极与电源的_______ 极相连。
(1)在酸式介质中,负极反应的物质为
负极:
(2)在碱式介质中,碱式电池的电极反应:
负极:
电解质溶液pH的变化
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4) 铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。工作时该电池总反应式为Pb+PbO2+2H2SO4
 2PbSO4+2H2O。根据上述情况判断:
2PbSO4+2H2O。根据上述情况判断: I.铅蓄电池的负极材料是
II.工作时,电解质溶液的pH
III.工作时,电解质溶液中的阴离子移向
IV. 充电时,铅蓄电池的负极与电源的
您最近一年使用:0次
名校
解题方法
10 . 原电池的发明是化学对人类的一项重大贡献。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入氢氧化钠溶液中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为_____ 。放电一段时间后,负极附近溶液的pH_____ (填“升高”“降低”或“不变”)。
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,其反应的离子方程式为_________________ 。请把该反应设计成一个原电池,在方框内面出原电池装置图(要求:标明电极材料和电解质溶液)。
_____
(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示, 测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

t1s 前,原电池的正极的电极反应式为____________________________ ,溶液中的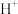 向
向_____________ (填“Al”或“Cu”)极移动。t1s后,外电路中电子流动方向发生改变,其原因是_____ 。
(1)一种新型燃料电池,它以多孔铂板为两个电极插入氢氧化钠溶液中,然后分别向两极通入氢气和氧气而获得电能。通入氢气的电极反应式为
(2)电子工业上常利用FeCl3溶液腐蚀铜板制作印刷电路,其反应的离子方程式为

(3)常温下,将除去表面氧化膜的铝片、铜片插入浓HNO3中组成原电池装置如图甲所示, 测得原电池的电流强度(I)随时间(t)的变化如图乙所示,反应过程中有红棕色气体产生。

t1s 前,原电池的正极的电极反应式为
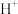 向
向
您最近一年使用:0次



