1 . 按要求回答问题。
(1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,可用___________ 作正极材料,正极反应的电极方程式为___________ 。
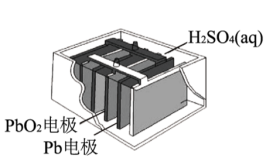
(2)氢氧燃料电池的构造如图所示,由此判断OH-向___________ (填“正”或“负”)极定向移动,Y极的电极反应式为___________ 。 Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量
Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量___________ (填“增大”或“减小”)。放电过程中,外电路中转移2.5 mol e-,消耗硫酸___________ mol。
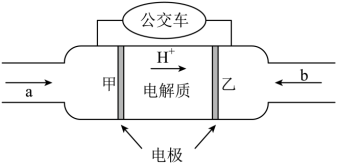
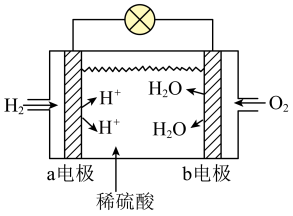
(4)某电解池装置如图所示,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则___________ 。
②Y电极上的电极反应式为___________ ,检验该电极反应产物的方法及现象是___________ 。
(1)制作印刷电路板的过程中常用FeCl3溶液与铜反应2Fe3++Cu=2Fe2++Cu2+,把该反应设计成原电池,可用
(2)氢氧燃料电池的构造如图所示,由此判断OH-向

 Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量
Pb+PbO2+2H2SO4。铅蓄电池放电时正极电极质量(4)某电解池装置如图所示,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
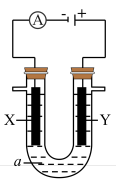
②Y电极上的电极反应式为
您最近半年使用:0次
2024-05-06更新
|
166次组卷
|
2卷引用:江苏省扬州市邗江中学2023-2024学年高一下学期三月检测化学试题
名校
2 . 积极发展清洁能源,推动经济社会绿色低碳转型,已经成为国际社会应对全球气候变化的普遍共识。
(1)甲醇 是一种重要的清洁燃料。甲醇燃烧时,能量的主要转化形式是
是一种重要的清洁燃料。甲醇燃烧时,能量的主要转化形式是____________ 转化为___________ ;其燃烧反应中反应物的总能量_____________ (填“大于”“小于”或“等于”)生成物的总能量。
(2)氢能是最理想的清洁能源。某氢能源公交车使用的燃料电池结构示意图(质子交换膜传导 )如图。
)如图。__________ 反应, 由
由_______ (填“M”或“N”,下同)极移向_________ 极。
②该电池工作时,M极的电极反应式为________________________________ 。
③与传统的发动机供能相比,氢能源供能的优点是_____________________ (任写一点)。
④每转移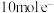 ,消耗氢气的质量为
,消耗氢气的质量为___________  。
。
(1)甲醇
 是一种重要的清洁燃料。甲醇燃烧时,能量的主要转化形式是
是一种重要的清洁燃料。甲醇燃烧时,能量的主要转化形式是(2)氢能是最理想的清洁能源。某氢能源公交车使用的燃料电池结构示意图(质子交换膜传导
 )如图。
)如图。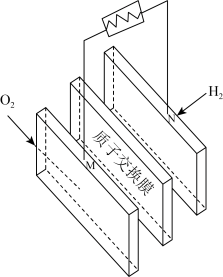
 由
由②该电池工作时,M极的电极反应式为
③与传统的发动机供能相比,氢能源供能的优点是
④每转移
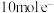 ,消耗氢气的质量为
,消耗氢气的质量为 。
。
您最近半年使用:0次
名校
3 . 汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应___________ (填“释放”或“吸收”)___________ kJ能量。
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从___________ (填“a”或“b”)处通入,正极反应方程式为___________ ,标况下消耗11.2L空气,整个电路中转移的电子数约为___________ NA。___________ ,负极电极反应式为___________ 。
(1)汽车尾气主要含有CO2、CO、SO2、NO等物质,是造成城市空气污染的主要因素之一,N2和O2反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应




| A.NaN3属于离子化合物 |
| B.NaN3的分解反应属于吸热反应 |
| C.E1表示2mol NaN3固体的能量 |
| D.NaN3作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,氢气从
您最近半年使用:0次
名校
解题方法
4 . 化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据原电池的本质判断,下列化学(或离子)方程式正确,且能设计成原电池的是___________。
(2)利用反应“ ”设计一个原电池,正极的电极反应式:
”设计一个原电池,正极的电极反应式:___________ 。
(3)以Pt为电极的氢氧燃料电池的工作原理示意图如图所示,稀 为电解质溶液。
为电解质溶液。___________ 极,发生___________ 反应(“氧化”或“还原”),写出b极的电极反应式___________ 。
②该电池提供 ,理论上消耗的氢气在标准状况下的体积为
,理论上消耗的氢气在标准状况下的体积为___________ L。
(1)根据原电池的本质判断,下列化学(或离子)方程式正确,且能设计成原电池的是___________。
A.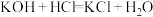 | B.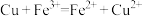 |
C.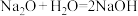 | D.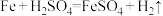 |
(2)利用反应“
 ”设计一个原电池,正极的电极反应式:
”设计一个原电池,正极的电极反应式:(3)以Pt为电极的氢氧燃料电池的工作原理示意图如图所示,稀
 为电解质溶液。
为电解质溶液。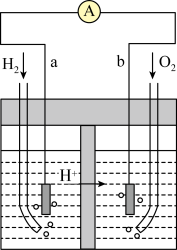
②该电池提供
 ,理论上消耗的氢气在标准状况下的体积为
,理论上消耗的氢气在标准状况下的体积为
您最近半年使用:0次
名校
解题方法
5 . 任何化学反应都伴随着能量的变化,化学能可转化为热能、电能等。回答下列有关问题:
(1)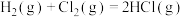 的反应过程如图所示:
的反应过程如图所示:______ (填“放热”或“吸热”)反应,生成 吸收或放出的热量为
吸收或放出的热量为______ 。
(2)下列变化中属于吸热反应的是______ (填标号)。
①液态水汽化 ②生石灰与水反应生成熟石灰
③ ④
④ 与固体
与固体 混合
混合
(3)氢气燃料电池在北京冬奥会上得到广泛应用,下图是一种氢气燃料电池的工作原理示意图:______ ,发生了______ 反应(填“氧化”或“还原”):a电极是原电池的______ (填“正极”或“负极”),若该极改为通入 ,其电极反应式为
,其电极反应式为____________ 。
(4)为了验证Fe与Cu的还原性强弱,下图中能达到实验目的的装置是______ (填标号),其正极的电极反应式为______ ;若构建该原电池时两个电极的质量相等,当导线中通过0.2 mol电子时,理论上两个电极的质量差为______ g。
(1)
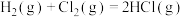 的反应过程如图所示:
的反应过程如图所示:
 吸收或放出的热量为
吸收或放出的热量为(2)下列变化中属于吸热反应的是
①液态水汽化 ②生石灰与水反应生成熟石灰
③
 ④
④ 与固体
与固体 混合
混合(3)氢气燃料电池在北京冬奥会上得到广泛应用,下图是一种氢气燃料电池的工作原理示意图:
 ,其电极反应式为
,其电极反应式为(4)为了验证Fe与Cu的还原性强弱,下图中能达到实验目的的装置是

您最近半年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从___________ 口通入(填“a”或“b”),X极为电池的___________ (填“正”或“负”)极,Y极的电极方程式为___________ 。
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的___________ 极;电子从该极___________ (填“流入”或“流出”)。
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH-2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Zn是___________ 极,Ag2O发生___________ 反应。
②电子由___________ 极流向___________ 极(填“Zn”或“Ag2O”),当电路通过1 mol电子时,负极消耗物质的质量是___________ g。
③在使用过程中,电解质溶液中KOH的物质的量___________ (填“增大”“减小”或“不变”)。
(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为:
Zn+2OH-2e-=ZnO+H2O Ag2O+H2O+2e-=2Ag+2OH-
总反应为Ag2O+Zn=ZnO+2Ag
①Zn是
②电子由
③在使用过程中,电解质溶液中KOH的物质的量
您最近半年使用:0次
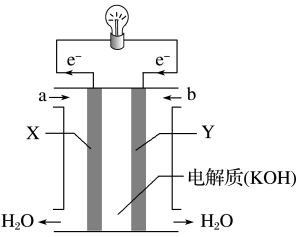
7 . 应用电化学原理,回答下列问题:
(1)上述三个装置中,负极反应的共同特点是_____________________ 。
(2)甲电池工作时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是________________ 。
(3)乙中正极反应式为____________________ ;若将H2换成CH4,则负极反应式为______________________ 。
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池______ 极相连接。
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按右图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:
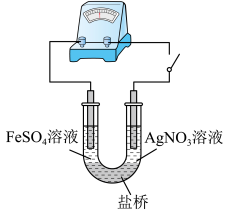
a.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
b.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流计指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验a中银作_________ 极。
② 综合实验a和b的现象,得出Ag+和Fe2+反应的离子方程式是_____________________ 。

(1)上述三个装置中,负极反应的共同特点是
(2)甲电池工作时,盐桥(装有含琼胶的KCl饱和溶液)中离子移动的方向是
(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,进行充电时,要将外接电源的负极与铅蓄电池
(5)应用原电池反应可以探究氧化还原反应进行的方向和程度。按右图连接装置并加入药品(盐桥中的物质不参与反应),进行实验:

a.K闭合时,指针偏移。放置一段时间后,指针偏移减小。
b.随后向U型管左侧逐渐加入浓Fe2(SO4)3溶液,发现电流计指针的变化依次为:偏移减小→回到零点→逆向偏移。
① 实验a中银作
② 综合实验a和b的现象,得出Ag+和Fe2+反应的离子方程式是
您最近半年使用:0次
解题方法
8 . 按要求写出下列离子方程式
(1)(NH4)2SO4水解:_______ 。
(2)NaHCO3水解:_______ 。
(3)Ag2CrO4沉淀溶解平衡:_______ 。
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+ O2=H2O。则负极反应式:
O2=H2O。则负极反应式:_______ 、正极反应式_______ 。
(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:_______ 。
②简要说明白色固体转化为黑色固体的原因:_______ 。
(1)(NH4)2SO4水解:
(2)NaHCO3水解:
(3)Ag2CrO4沉淀溶解平衡:
(4)氢氧燃料电池(酸性):已知总电极反应式为H2+
 O2=H2O。则负极反应式:
O2=H2O。则负极反应式:(5)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl和水形成的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
①写出白色固体转化为黑色固体的化学方程式:
②简要说明白色固体转化为黑色固体的原因:
您最近半年使用:0次
名校
解题方法
9 . 我国利用氯碱厂生产的H2作燃料,将氢燃料电站应用于氯碱工业,其示意图如图。
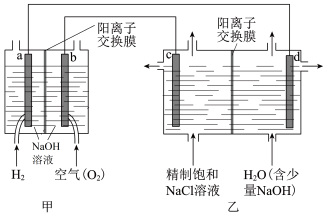
(1)a电极反应式是_______ 。
(2)乙装置中电解饱和NaCl溶液的化学方程式为_______ 。
(3)结合化学用语解释d极区产生NaOH的原因_______ 。
(4)电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用_______ 。
(5)下列说法正确的是_______ 。

(1)a电极反应式是
(2)乙装置中电解饱和NaCl溶液的化学方程式为
(3)结合化学用语解释d极区产生NaOH的原因
(4)电解时用盐酸控制阳极区溶液的pH在2~3。用化学平衡移动原理解释盐酸的作用
(5)下列说法正确的是
| A.甲装置可以实现电能向化学能转化 |
| B.甲装置中Na+透过阳离子交换膜向a极移动 |
| C.乙装置中c极一侧流出的是淡盐水 |
| D.理论上,每消耗2.24LH2(标况下),可制得0.2molNaOH |
您最近半年使用:0次
名校
解题方法
10 . 按要求回答下列问题。
(1)写出葡萄糖的结构简式
(2)写出铝和氢氧化钠溶液反应的离子方程式
(3)试管内壁附着的硫单质可用热的烧碱溶液洗涤除去,生成的产物中有
 和
和 ,请写出对应的化学方程式
,请写出对应的化学方程式(4)电解质为氢氧化钾溶液的氢氧燃料电池如图所示,写出a极的电极反应式

您最近半年使用:0次



