名校
1 . 氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确 的是
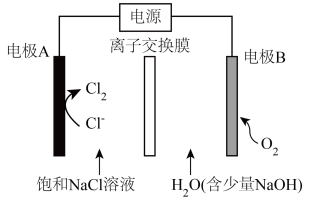
| A.电极A接电源正极,该电极电势高 |
B.电极 的电极反应式为: 的电极反应式为: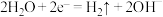 |
C.应选用阳离子交换膜,在右室获得浓度较高的 溶液 溶液 |
| D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗 |
您最近一年使用:0次
名校
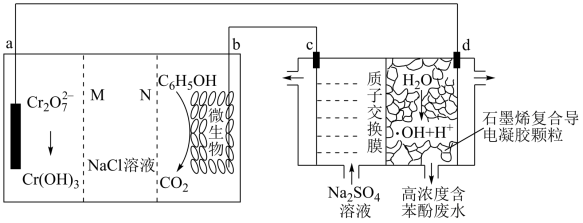
2 . 羟基自由基( )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 、
、 的原电池-电解池组合装置(如图),该装置能实现发电、环保二位一体。下列说法正确的是
的原电池-电解池组合装置(如图),该装置能实现发电、环保二位一体。下列说法正确的是
 )是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为
)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种能将苯酚氧化为 、
、 的原电池-电解池组合装置(如图),该装置能实现发电、环保二位一体。下列说法正确的是
的原电池-电解池组合装置(如图),该装置能实现发电、环保二位一体。下列说法正确的是
| A.电池工作时,b电极附近pH增加 |
B.a极每单个 参与反应,通过质子交换膜的H+数理论上有6NA个 参与反应,通过质子交换膜的H+数理论上有6NA个 |
C.d极区苯酚被氧化的化学方程式为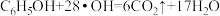 |
| D.右侧装置中,每转移0.7mol电子,c、d两极共产生气体11.2L |
您最近一年使用:0次
2021-11-20更新
|
540次组卷
|
5卷引用:黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题
黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题(已下线)一轮巩固卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(辽宁专用)(已下线)押新高考卷12题 电化学基础-备战2022年高考化学临考题号押题(新高考通版)湖北省襄阳市第五中学2022届高三适应性考试(四模)化学试题
名校
解题方法
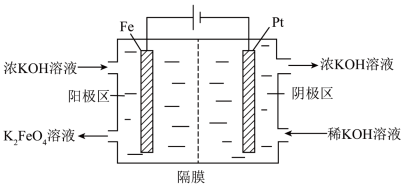
3 . 在强碱中氢氧化铁可被一些氧化剂氧化为高铁酸根离子( ),
), 在酸性条件下氧化性极强且不稳定。隔膜电解法制备
在酸性条件下氧化性极强且不稳定。隔膜电解法制备 的工作原理如图所示。下列说法错误的是
的工作原理如图所示。下列说法错误的是
 ),
), 在酸性条件下氧化性极强且不稳定。隔膜电解法制备
在酸性条件下氧化性极强且不稳定。隔膜电解法制备 的工作原理如图所示。下列说法错误的是
的工作原理如图所示。下列说法错误的是
| A.隔膜为阳离子交换膜 |
| B.由于阴极区产KOH,故电解过程中不需要额外补充 |
C.Fe电极上的反应为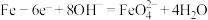 |
D.电路中每转移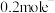 ,Pt电极上理论上产生2.24L气体(标准状况) ,Pt电极上理论上产生2.24L气体(标准状况) |
您最近一年使用:0次
2024-01-21更新
|
281次组卷
|
3卷引用:黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题
黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)海南省海南中学2023-2024学年高三下学期第6次月考化学试题
名校
解题方法
4 . 工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
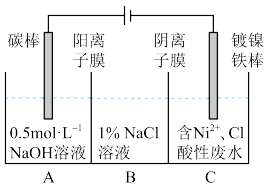
| A.碳棒上发生的电极反应:4OH- -4e- =O2↑+2H2O |
| B.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
| C.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小 |
| D.为了提高Ni的产率,电解过程中需要控制废水pH |
您最近一年使用:0次
2022-11-10更新
|
995次组卷
|
67卷引用:黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题
黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题2015届浙江省台州中学高三上学期第三次统练考试理综试卷2015届浙江省台州中学高三上学期第三次统练理综化学试卷2015届福建省漳州市高三5月适应性考试化学试卷2015-2016学年山西省怀仁一中高二12月月考化学试卷2017届浙江省温州中学高三上10月高考模拟化学试卷2016-2017学年浙江省绍兴一中高二上期中化学试卷2016-2017学年湖南省衡阳八中高二上月考五化学卷2016-2017学年湖北省华中师范大学第一附属中学高二上学期期末考试化学试卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷2017届江苏省泰州中学高三下学期期初考试化学试卷2016-2017学年湖南省衡阳市第八中学高一下学期理科实验班第一次月考理科综合化学试卷2017届重庆市万州区高三下学期“二诊”模拟考试化学试卷2016-2017学年四川省成都市第七中学高二下学期半期考试化学试卷福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题辽宁省瓦房店市高级中学2017-2018学年高二上学期12月月考化学试题(已下线)黄金30题系列++高二化学(选修4)++++小题好拿分【基础版】山东省临沂市第十九中学2017-2018学年高二上学期第五次质量调研化学试题四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题(已下线)2018年9月23日 《每日一题》 一轮复习-每周一测高二人教版选修4 第四章 重难点专题练——原电池和电解池的综合应用【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二下学期第三次月考化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测浙江省嘉兴市第一中学、湖州中学2019-2020学年高二上学期期中联考化学试题重庆一中2019-2020学年高二上学期期中考试化学试题河南省洛阳市第一高级中学2019-2020学年高二12月月考化学试题湖南省邵阳市邵东县创新实验学校2020届高三上学期第五次月考化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题17 带隔膜的电化学装置云南省曲靖二中2020届高三第一次月考理综化学试题(已下线)【南昌新东方】2018-2019莲塘一中 高三12月 014四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用(已下线)【浙江新东方】47人教版(2019)高二化学选择性必修1第四章 化学反应与电能 易错疑难集训(二)(已下线)第四章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)福建省福州市第四中学2021届高三上学期11月月考化学试题重庆市沙坪坝区重庆市第七中学2020-2021高二上学期中考试化学试题湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题河北正定中学2020-2021学年高三第二次半月考化学试题河北省衡水市武强中学2022届高三上学期第一次月考化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)期末综合测试卷01-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)第六单元 化学反应与能量(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)4.2.2 电解原理的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题30 电化学中的交换膜-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)辽宁省朝阳市建平县实验中学2021-2022学年高二上学期第三次月考化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题山西省晋城市第一中学2021-2022学年高二上学期12月月考化学试题江西省宜春市上高二中2021-2022学年高二下学期第四次月考试题(3月)化学试题云南省曲靖市罗平县第五中学2021-2022学年高二4月月考化学试题四川省绵阳南山中学2021-2022学年高二下学期期中考试化学试题内蒙古喀喇沁旗锦山蒙古族中学2021-2022学年高二下学期开学考试化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题辽宁省实验中学2022-2023学年高二上学期期中阶段测试化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题08 新型化学电源(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题(已下线)选择题11-16陕西省西安市2023-2024学年高二上学期期末化学测试卷B河北省石家庄二中润德2023-2024学年高二上学期12月月考化学试题宁夏吴忠中学2023-2024学年高二上学期期末考试化学试题广东省汕头市金山中学2023-2024学年高二上学期期末考试 化学试题四川省什邡中学2023-2024学年高二下学期4月第一次月考化学试题
5 . 镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成。
放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究。
已知 :①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+。
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的正极反应式为;_______________________________________ ;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作______________ s。(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:
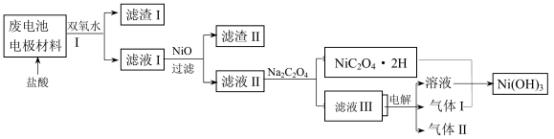
①方案中加入适量双氧水的目的是____________ ;在滤液I中慢慢加入NiO固体,则依次析出沉淀
________ 和沉淀__________ (填化学式)。若两种沉淀都析出,pH应控制在不超过______________
(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案_______________________________________________________ 。
②滤液III中溶质的主要成分是___________ (填化学式);气体I为___________ ,判断依据是_________________________________________________________________________ 。
放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁。由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究。
已知 :①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+。
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
回答下列问题:
(1)该电池的正极反应式为;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作
(3)对该电池电极材料进行回收方案设计:

①方案中加入适量双氧水的目的是
(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案
②滤液III中溶质的主要成分是
您最近一年使用:0次
名校
6 . 某研究小组用甲烷燃料电池作为电源,进行电解实验的相关研究。

(1)若乙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_____ 。
(2)若用乙装置给铜件镀银,电镀液是____ 溶液。电镀前a、b两电极质量相等,当甲池中消耗标况下1.12L甲烷时,a、b两电极质量相差____ g。
(3)若用乙装置电解CuCl2溶液,a、b电极均为碳棒,实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl。
为探究阴极碳棒上附着的红色、白色物质,设计了如图实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入如图所示装置b中,进行实验。

实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g。
①碳棒上的红色物质是_____ 。
②装置b中发生反应的化学方程式是____ 。
③电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为_____ 。
④保持电流强度为a安培,电解时间为T秒,经测定,得到红色物质质量为12.8g,白色物质质量为9.95g,计算该装置在本次电解中的电流效率η=_____ (化成最简式)。
(设:法拉第常数为F,单位为C•mol-1;η= ×100%)
×100%)

(1)若乙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
| A.a电极为纯铜 | B.粗铜接电源正极,发生还原反应 |
| C.CuSO4溶液的浓度保持不变 | D.利用阳极泥可回收Ag、Pt、Au等金属 |
(3)若用乙装置电解CuCl2溶液,a、b电极均为碳棒,实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
为探究阴极碳棒上附着的红色、白色物质,设计了如图实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入如图所示装置b中,进行实验。

实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g。
①碳棒上的红色物质是
②装置b中发生反应的化学方程式是
③电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为
④保持电流强度为a安培,电解时间为T秒,经测定,得到红色物质质量为12.8g,白色物质质量为9.95g,计算该装置在本次电解中的电流效率η=
(设:法拉第常数为F,单位为C•mol-1;η=
 ×100%)
×100%)
您最近一年使用:0次
名校
7 . 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
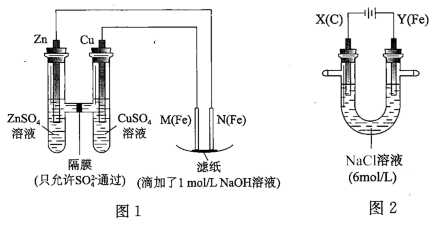
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__ (填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__ 。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__ (填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____ g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__ 。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
2019-06-28更新
|
411次组卷
|
21卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题
黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题(已下线)《2018-2019学年同步单元双基双测AB卷》第四单元 电化学基础单元测试A卷云南省广南二中2018-2019学年高二6月考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题2云南省迪庆州香格里拉中学2019-2020学年高二上学期期末考试化学试题云南省武定民族中学2019-2020学年高二上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题贵州省三都水族自治县高级中学2019-2020学年高二上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高二上学期期末考试化学试题贵州省三穗县三中2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县第二中学2019-2020学年高二上学期期末考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题云南省玉溪市江川区第二中学2020-2021学年高二下学期期中考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题
名校
解题方法
8 . 研究发现,以非晶态Ni( )基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
 )基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
)基硫化物为催化剂,能有效催化OER(析氧反应)和UOR(尿素氧化反应),从而降低电解水制氢过程中的能耗,其工作原理和反应机理如图所示:
| A.产生5.6L O2,电路中转移的电子数为2NA |
B.电极A的反应为 ,电极A附近溶液的碱性增强 ,电极A附近溶液的碱性增强 |
| C.UOR分两步进行,其中没有非极性键的形成或断裂 |
| D.若将光伏电池改为铅蓄电池,电解过程中电极B应连接铅蓄电池的Pb极 |
您最近一年使用:0次
2024-05-15更新
|
149次组卷
|
2卷引用:黑龙江省大庆市2024届高三下学期第三次质量检测三模化学试题
名校
9 . 羟基自由基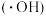 具有很强的氧化性,能将苯酚氧化为
具有很强的氧化性,能将苯酚氧化为 和
和 。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
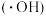 具有很强的氧化性,能将苯酚氧化为
具有很强的氧化性,能将苯酚氧化为 和
和 。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是
。我国科学家开发出如图所示装置,能实现制备氢气、处理含苯酚废水二位一体。下列说法正确的是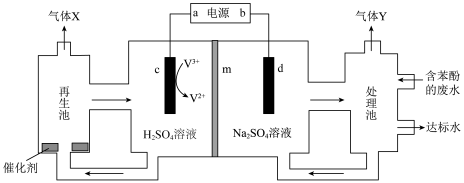
A.d电极的电极反应式: |
B.再生池中发生的反应: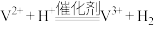 |
C.a为电源负极,m为阴离子交换膜, 能增强导电性 能增强导电性 |
D.气体X与Y在相同条件下的体积比为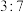 |
您最近一年使用:0次
7日内更新
|
537次组卷
|
5卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
10 . Ar气氛下,高价态钒镁氧化物晶体作为催化剂进行乙苯脱氢制备苯乙烯,并将CO2转化为CO,反应机理如图(a)所示;同时采用电解法处理含苯乙烯的废水,其工作原理如图(b)(电解液是含苯乙烯和硫酸的废水,pH≈ 6),已知:·OH具有很强的氧化性。下列说法不正确的是
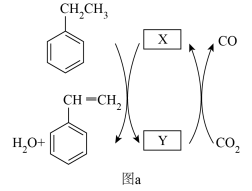
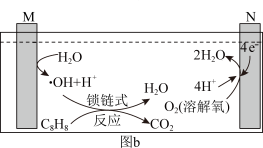


| A.图a由MgVmOn+1转化为MgVmOn的过程,乙苯发生氧化反应 |
| B.M连接电源的正极 |
| C.苯乙烯被·OH氧化的化学方程式为C8H8-40e- +40·OH =8CO2↑+ 24H2O |
| D.若电路中通过10mol电子,理论上有26g苯乙烯(M= 104 g/mol)被氧化成CO2和H2O |
您最近一年使用:0次



