名校
解题方法
1 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 mol⸱L−1 的AgNO3溶液,乙池为1 mol⸱L−1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是


A.实验开始先断开K1,闭合K2,此时 向B电极移动 向B电极移动 |
| B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
您最近一年使用:0次
名校
解题方法
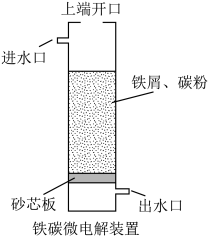
2 . 铁碳微电解技术是处理酸性废水的一种工艺,装置如图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基( );若上端口关闭,可得到强还原性中间体氢原子(
);若上端口关闭,可得到强还原性中间体氢原子(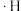 )。下列说法错误的是
)。下列说法错误的是
 );若上端口关闭,可得到强还原性中间体氢原子(
);若上端口关闭,可得到强还原性中间体氢原子(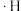 )。下列说法错误的是
)。下列说法错误的是
| A.自由基均为阴极产物 |
B. 完全转化为羟基自由基( 完全转化为羟基自由基( )时转移了2mol电子 )时转移了2mol电子 |
| C.若处理含酚类的酸性废水,则上端口应关闭 |
D.处理含 的酸性废水后,体系pH升高 的酸性废水后,体系pH升高 |
您最近一年使用:0次
解题方法
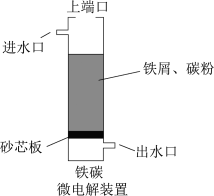
3 . 铁碳微电解技术是处理酸性废水的一种工艺。装置图如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基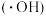 。若上端口关闭。可得到强还原性中间体氢原子
。若上端口关闭。可得到强还原性中间体氢原子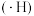 。下列说法正确的是
。下列说法正确的是
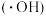 。若上端口关闭。可得到强还原性中间体氢原子
。若上端口关闭。可得到强还原性中间体氢原子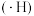 。下列说法正确的是
。下列说法正确的是
A. 完全转化为羟基自由基 完全转化为羟基自由基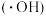 时转移了 时转移了 电子 电子 |
B.无论上端口是关闭还是打开,正极反应式均为: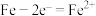 |
| C.若处理含酚类的酸性废水,则上端口应关闭 |
| D.若处理重铬酸根的酸性废水,则上端口应打开并鼓入空气 |
您最近一年使用:0次
名校
4 . 卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
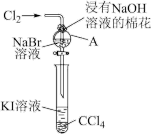
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
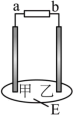
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近一年使用:0次
名校
5 . 某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
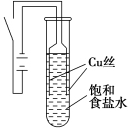
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
| 颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是
| A.反应结束后最终溶液呈碱性 |
| B.阴极上发生的电极反应为:2H2O + 2e-═ H2↑+ 2OH- |
| C.电解过程中氯离子移向阳极 |
| D.试管底部红色的固体具有还原性 |
您最近一年使用:0次
2015-05-13更新
|
1986次组卷
|
5卷引用:2015届贵州省八校联盟高三第二次联考理综化学试卷
解题方法
6 . “浓差电池”利用某离子浓度大其氧化性或还原性强的特点而设计的。如图,甲池为3 mol/L的AgNO3溶液,乙池为1 mol/L的AgNO3溶液,A、B均为Ag电极。实验时先闭合K2,断开K1,发现电流计指针发生偏转。下列说法错误的是
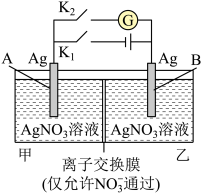

| A.一段时间后电流计指针将归零,此时可视为反应达到平衡 |
| B.当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升 |
| C.当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加 |
D.实验开始先闭合K2,断开K1,此时 向B电极移动 向B电极移动 |
您最近一年使用:0次
名校
7 . 下列实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用石墨电极电解等浓度的足量FeCl3、CuCl2混合溶液 | 阴极有红色固体物质析出 | 金属活动性:Fe>Cu |
| B | 取适量NaHCO3固体于试管中,滴入少量水并用温度计检测 | 试管内温度上升,NaHCO3结块变为晶体 | NaHCO3溶于水放热 |
| C | 向AlCl3溶液中逐滴加入稀氨水至过量 | 产生白色沉淀,并逐渐增多,后慢慢溶解 | 碱性:NH3•H2O>Al(OH)3 |
| D | 向足量NaBr溶液中通入少量氯气,再加入淀粉KI溶液 | 溶液先变橙色,后变为蓝色 | 氧化性:Cl2>Br2>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-04-29更新
|
156次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
名校
8 . 氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确 的是
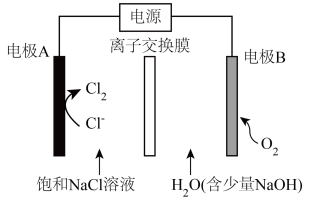
| A.电极A接电源正极,该电极电势高 |
B.电极 的电极反应式为: 的电极反应式为: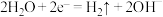 |
C.应选用阳离子交换膜,在右室获得浓度较高的 溶液 溶液 |
| D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗 |
您最近一年使用:0次
解题方法
9 . 结合所学知识,回答下列问题。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为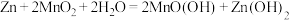 ,写出负极电极反应式
,写出负极电极反应式_____ 。
②将 设计成双液电池:正极烧杯中盛放的溶液为
设计成双液电池:正极烧杯中盛放的溶液为_____ ,电池正极的电极反应式为_____ 。
(2)下图是以石墨为电极,电解饱和食盐水的装置:
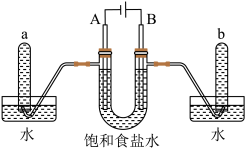
①电解时,A电极发生的电极下应式为_____ 。
②检验b试管中气体的操作是_____ 。
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答下列问题:
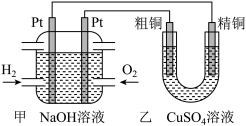
①甲装置中通入氧气的电极为_____ (填“正极”或“负极”),该极发生的电极反应式为_____ 。
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有_____ 。乙装置中反应一段时间后, 溶液的
溶液的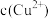
_____ (填“增大”、“减小”或“不变”)。
③在标准状况下,甲装置有 氧气参加反应,则乙装置中阴极析出铜的质量理论上为
氧气参加反应,则乙装置中阴极析出铜的质量理论上为_____ g。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为
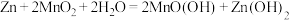 ,写出负极电极反应式
,写出负极电极反应式②将
 设计成双液电池:正极烧杯中盛放的溶液为
设计成双液电池:正极烧杯中盛放的溶液为(2)下图是以石墨为电极,电解饱和食盐水的装置:

①电解时,A电极发生的电极下应式为
②检验b试管中气体的操作是
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答下列问题:

①甲装置中通入氧气的电极为
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有
 溶液的
溶液的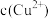
③在标准状况下,甲装置有
 氧气参加反应,则乙装置中阴极析出铜的质量理论上为
氧气参加反应,则乙装置中阴极析出铜的质量理论上为
您最近一年使用:0次
名校
解题方法
10 . 常用电解法处理工业废水中的乙醛。该过程中发生的电极反应为:
①4H2O+4e-=2H2↑+4OH-
②CH3CHO+3H2O-10e-=2CO2↑+10H+
③2H2O-4e-=O2↑+4H+
④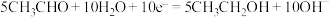
⑤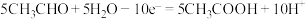
下列说法错误的是
①4H2O+4e-=2H2↑+4OH-
②CH3CHO+3H2O-10e-=2CO2↑+10H+
③2H2O-4e-=O2↑+4H+
④
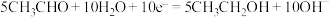
⑤
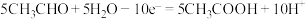
下列说法错误的是
| A.反应①⑤发生在阴极 |
| B.乙醛既体现氧化性又体现还原性 |
| C.当生成46g乙醇时,电路中转移2mol 电子 |
| D.电解过程中,电极附近溶液的pH: 阴极>阳极 |
您最近一年使用:0次
2021-03-18更新
|
617次组卷
|
4卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
山东省青岛市2021届高三3月统一质量检测化学试题(已下线)小题17 新型电解池装置 ——备战2021年高考化学经典小题考前必刷(全国通用)(已下线)专题08 电化学及其应用-备战2022年高考化学真题及地市好题专项集训【山东专用】山东省济南市第一中学2021-2022学年高二上学期期中考试化学试题



