1 . 目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:___ 。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
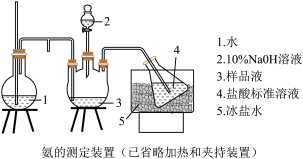
NH4Cl的电子式为___ 。盛放样品液的仪器是___ (填名称);圆底烧瓶中长玻璃导管的作用是___ ;冰盐水的作用是___ 。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___ 。
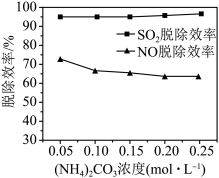
②NO脱除效率总是小于SO2脱除效率的主要原因是___ 。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
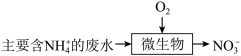
下列有关说法正确的是___ (填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH 直接转化为NO
直接转化为NO
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH
 )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO )的浓度也随之变大,写出该反应的离子方程式:
)的浓度也随之变大,写出该反应的离子方程式:②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2mol•L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。

NH4Cl的电子式为
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是

②NO脱除效率总是小于SO2脱除效率的主要原因是
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:

下列有关说法正确的是
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH
 直接转化为NO
直接转化为NO
您最近半年使用:0次
解题方法
2 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(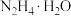 )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
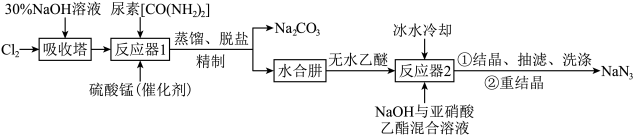
已知:①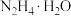 易溶于水,具有强还原性,易被氧化成N2;
易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成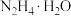
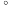
(1)写出反应器1中生成水合肼的化学方程式:___________ 。
(2)反应器2中加入无水乙醚的作用是___________ 。
(3)已知亚硝酸乙酯的结构简式为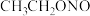 。写出反应器2中生成NaN3和
。写出反应器2中生成NaN3和 的化学方程式:
的化学方程式:________ 。若生成39gNaN3,则该反应中转移电子的物质的量为_______ 。
(4)反应器1要控制 NaClO溶液的用量,其主要目的是___________ 。
(5)某实验室设计了如图所示装置制备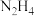 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成OH-和H+并可分别通过阴、阳膜定向移动。
解离成OH-和H+并可分别通过阴、阳膜定向移动。
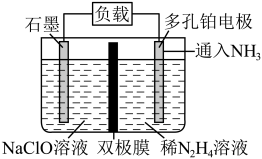
①双极膜中产生的___________ (填“H⁺”或“OH-”)移向多孔铂电极。
②石墨电极反应式为___________ 。
(6)对于反应中生成的碳酸钠,可以通过以下过程转化为亚硫酸钠。

 常用作还原性漂白剂。在测定某液体葡萄糖中
常用作还原性漂白剂。在测定某液体葡萄糖中 残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为
残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为___________ ,该样品中 残留量为
残留量为___________ g·L−1。(以SO2计,结果保留1位小数)
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(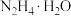 )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
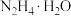 易溶于水,具有强还原性,易被氧化成N2;
易溶于水,具有强还原性,易被氧化成N2;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
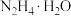
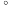
(1)写出反应器1中生成水合肼的化学方程式:
(2)反应器2中加入无水乙醚的作用是
(3)已知亚硝酸乙酯的结构简式为
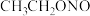 。写出反应器2中生成NaN3和
。写出反应器2中生成NaN3和 的化学方程式:
的化学方程式:(4)反应器1要控制 NaClO溶液的用量,其主要目的是
(5)某实验室设计了如图所示装置制备
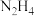 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成OH-和H+并可分别通过阴、阳膜定向移动。
解离成OH-和H+并可分别通过阴、阳膜定向移动。
①双极膜中产生的
②石墨电极反应式为
(6)对于反应中生成的碳酸钠,可以通过以下过程转化为亚硫酸钠。

 常用作还原性漂白剂。在测定某液体葡萄糖中
常用作还原性漂白剂。在测定某液体葡萄糖中 残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为
残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为 残留量为
残留量为
您最近半年使用:0次
2022·全国·模拟预测
解题方法
3 . 某实验小组利用如图所示装置制备高铁酸钾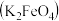 并探究其性质。
并探究其性质。
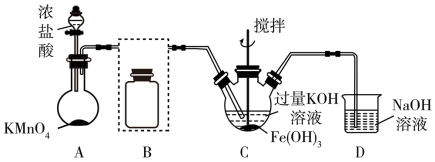
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。下列说法错误的是
,在碱性溶液中较稳定。下列说法错误的是
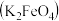 并探究其性质。
并探究其性质。
资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。下列说法错误的是
,在碱性溶液中较稳定。下列说法错误的是| A.装置A中发生反应的化学方程式是2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O |
| B.试剂瓶B中盛放的试剂为饱和的碳酸氢钠溶液 |
| C.从装置C中分离出高铁酸钾的操作是过滤 |
| D.以高浓度的KOH溶液为电解液,铁和石墨为电极材料,采用电解法也可以制备高铁酸钾,电解时铁作阴极 |
您最近半年使用:0次
解答题-原理综合题
|
适中(0.65)
|
解题方法
4 . 完成下列问题。
(1)已知:①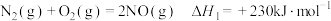
②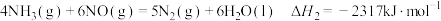
则表示氨气摩尔燃烧焓的热化学方程式为___________ ,该反应可设计为碱性条件下的燃料电池,负极电极反应式为___________ 。
(2)已知几种化学键的键能和热化学方程式如下:
 ,则
,则
___________ 。
(3)4种不饱和烃分别与氢气发生加成反应生成 环己烷(
环己烷(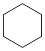 )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应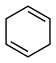 (1)=
(1)=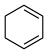 (1)的
(1)的
___________ 。
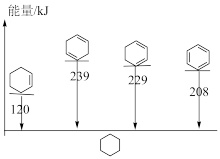
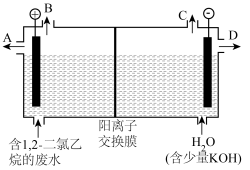
(4)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基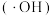 ,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:___________ ;羟基自由基与1,2-二氯乙烷反应的化学方程式为___________ 。
(1)已知:①
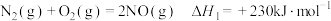
②
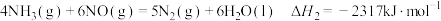
则表示氨气摩尔燃烧焓的热化学方程式为
(2)已知几种化学键的键能和热化学方程式如下:
| 化学键 |  |  |  |  |  |
键能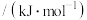 | 391 | 193 | 243 |  | 432 |
 ,则
,则
(3)4种不饱和烃分别与氢气发生加成反应生成
 环己烷(
环己烷( )的能量变化如图所示。根据图示计算反应
)的能量变化如图所示。根据图示计算反应 (1)=
(1)= (1)的
(1)的

(4)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基
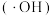 ,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解含1,2-二氯乙烷的废水的装置图,写出电解池阴极的电极反应式:
您最近半年使用:0次
名校
解题方法
5 . 铁碳微电解技术是处理酸性废水的一种工艺,装置如图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基( );若上端口关闭,可得到强还原性中间体氢原子(
);若上端口关闭,可得到强还原性中间体氢原子(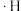 )。下列说法错误的是
)。下列说法错误的是
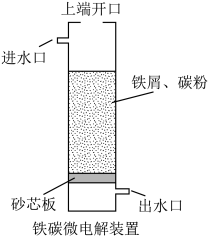
 );若上端口关闭,可得到强还原性中间体氢原子(
);若上端口关闭,可得到强还原性中间体氢原子(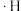 )。下列说法错误的是
)。下列说法错误的是
| A.自由基均为阴极产物 |
B.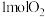 完全转化为羟基自由基( 完全转化为羟基自由基( )时转移了2mol电子 )时转移了2mol电子 |
| C.若处理含酚类的酸性废水,则上端口应关闭 |
D.处理含 的酸性废水后,体系pH升高 的酸性废水后,体系pH升高 |
您最近半年使用:0次
名校
解题方法
6 . 当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 mol⸱L−1 的AgNO3溶液,乙池为1 mol⸱L−1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是


A.实验开始先断开K1,闭合K2,此时 向B电极移动 向B电极移动 |
| B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等 |
| C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加 |
| D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大 |
您最近半年使用:0次
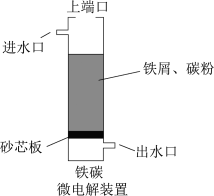
解题方法
7 . 铁碳微电解技术是处理酸性废水的一种工艺。装置图如下图所示。若上端口打开,并鼓入空气,可得到强氧化性中间体羟基自由基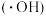 。若上端口关闭。可得到强还原性中间体氢原子
。若上端口关闭。可得到强还原性中间体氢原子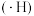 。下列说法正确的是
。下列说法正确的是
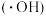 。若上端口关闭。可得到强还原性中间体氢原子
。若上端口关闭。可得到强还原性中间体氢原子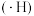 。下列说法正确的是
。下列说法正确的是
A. 完全转化为羟基自由基 完全转化为羟基自由基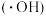 时转移了 时转移了 电子 电子 |
B.无论上端口是关闭还是打开,正极反应式均为: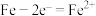 |
| C.若处理含酚类的酸性废水,则上端口应关闭 |
| D.若处理重铬酸根的酸性废水,则上端口应打开并鼓入空气 |
您最近半年使用:0次
名校
8 . 卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
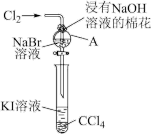
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
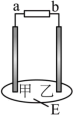
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近半年使用:0次
解题方法
9 . 以石墨作电极,电解AgNO3溶液,可在两极分别得到Ag和O2,下列说法正确的是
A.氧化性:Ag+ > H+,还原性:NO > OH- > OH- |
| B.Ag附着在阳极:Ag+ + e-=Ag |
| C.电解过程中溶液的酸性将逐渐减弱 |
| D.电路中每转移1mol电子,可生成1molAg和0.25molO2 |
您最近半年使用:0次
2020-11-09更新
|
1013次组卷
|
7卷引用:北京市丰台区2020-2021学年高二上学期期中考试化学试题
北京市丰台区2020-2021学年高二上学期期中考试化学试题(已下线)专题4.3.1 电解原理-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)第四章 电化学基础(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)(已下线)4.3.1 电解原理(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)4.2.1 电解原理(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)【教材实验热点】09 化学能与电能(已下线)第四章 化学反应与电能(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)
解题方法
10 . 污水处理是保护环境的需要,是每家企业应尽的义务。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
(1)还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_____ 。
②还原+6价铬还可选用以下的试剂_____ (填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
③在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在____ (填序号)最佳,第2次应调节溶液的pH范围约在____ (填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液pH的最佳试剂为:____ (填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(2)电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
④写出阴极的电极反应式_____ 。
⑤电解法中加入氯化钠的作用是_____ 。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
(1)还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式
②还原+6价铬还可选用以下的试剂
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
③在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液pH的最佳试剂为:
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(2)电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
④写出阴极的电极反应式
⑤电解法中加入氯化钠的作用是
您最近半年使用:0次



