名校
1 . 某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
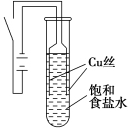
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
*相同温度下CuCl的溶解度大于CuOH
下列说法错误的是

实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
| 物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
| 颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
下列说法错误的是
| A.反应结束后最终溶液呈碱性 |
| B.阴极上发生的电极反应为:2H2O + 2e-═ H2↑+ 2OH- |
| C.电解过程中氯离子移向阳极 |
| D.试管底部红色的固体具有还原性 |
您最近一年使用:0次
2015-05-13更新
|
1990次组卷
|
5卷引用:【全国百强校】云南省曲靖市第一中学2018-2019学年高二上学期期末考试化学试题
解题方法
2 . 结合所学知识,回答下列问题。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为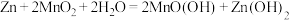 ,写出负极电极反应式
,写出负极电极反应式_____ 。
②将 设计成双液电池:正极烧杯中盛放的溶液为
设计成双液电池:正极烧杯中盛放的溶液为_____ ,电池正极的电极反应式为_____ 。
(2)下图是以石墨为电极,电解饱和食盐水的装置:
①电解时,A电极发生的电极下应式为_____ 。
②检验b试管中气体的操作是_____ 。
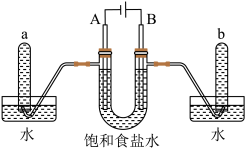
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答下列问题:
①甲装置中通入氧气的电极为_____ (填“正极”或“负极”),该极发生的电极反应式为_____ 。
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有_____ 。乙装置中反应一段时间后, 溶液的
溶液的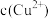
_____ (填“增大”、“减小”或“不变”)。
③在标准状况下,甲装置有 氧气参加反应,则乙装置中阴极析出铜的质量理论上为
氧气参加反应,则乙装置中阴极析出铜的质量理论上为_____ g。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为
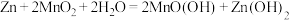 ,写出负极电极反应式
,写出负极电极反应式②将
 设计成双液电池:正极烧杯中盛放的溶液为
设计成双液电池:正极烧杯中盛放的溶液为(2)下图是以石墨为电极,电解饱和食盐水的装置:

①电解时,A电极发生的电极下应式为
②检验b试管中气体的操作是
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答下列问题:

①甲装置中通入氧气的电极为
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有
 溶液的
溶液的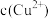
③在标准状况下,甲装置有
 氧气参加反应,则乙装置中阴极析出铜的质量理论上为
氧气参加反应,则乙装置中阴极析出铜的质量理论上为
您最近一年使用:0次
3 . KIO3是一种重要的无机化合物 ,可作为食盐中的补碘剂。回答下列问题:
(1)下列有关KIO3的说法错误的是______________ 。
a.既具有氧化性又具有还原性 b.属于强电解质 c.难溶于四氯化碳 d.名称为高碘酸钾
(2)利用“ KC1O3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有 KH(IO3)2、Cl2和 KCl 。该条件下, 、
、 、I2三者氧化性由强到弱的顺序是
、I2三者氧化性由强到弱的顺序是_______ ,“滤液”中的溶质主要是________ ,“逐 Cl2” 排出的Cl2需用碱液吸收,该反应的离子方程式为_________ ,“调 pH ”中可选用的一种强碱为_________ (填化学式)。
(3)KIO3也可采用“电解法”制备,装置如图所示。
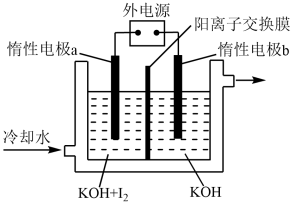
①a电极应连接外接电源的________ (填“正极”或“负极”)。
②电解过程中 b 电极区域溶液的 pH将______ (填“升高”、“降低”或“不变”)。
③与“电解法”相比,“KC1O3氧化法”的主要不足之处有______ (写出一点)。
(1)下列有关KIO3的说法错误的是
a.既具有氧化性又具有还原性 b.属于强电解质 c.难溶于四氯化碳 d.名称为高碘酸钾
(2)利用“ KC1O3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有 KH(IO3)2、Cl2和 KCl 。该条件下,
 、
、 、I2三者氧化性由强到弱的顺序是
、I2三者氧化性由强到弱的顺序是(3)KIO3也可采用“电解法”制备,装置如图所示。

①a电极应连接外接电源的
②电解过程中 b 电极区域溶液的 pH将
③与“电解法”相比,“KC1O3氧化法”的主要不足之处有
您最近一年使用:0次
4 . 重铬酸钾在实验室和生产、生活中都有很广泛的应用。
(1)酒后驾车是引发交通事故的重要原因,危害极大。交警对驾驶员进行呼气酒精检测时利用了重铬酸钾的强氧化性。其原理如下:
_______ _______
_______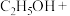 _______
_______ _______
_______ _______
_______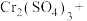 _______
_______ _______
_______
请配平上述反应的化学方程式_______ 。
(2)某化学兴趣小组设计了如图所示装置,用电解法把 转化为
转化为 。
。
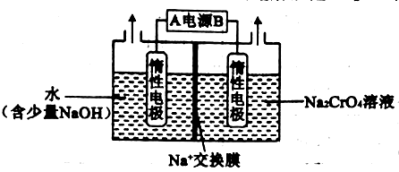
A为_______ 极(填“正”或“负”)。电解过程中, 的移动方向为:左
的移动方向为:左_______ 右(填“→”或“←”), 在阳极区产生的原理为
在阳极区产生的原理为_______ (用电极反应式和离子方程式表示),当电路中通过2mol电子时,产生_______ mol  。
。
(1)酒后驾车是引发交通事故的重要原因,危害极大。交警对驾驶员进行呼气酒精检测时利用了重铬酸钾的强氧化性。其原理如下:
_______
 _______
_______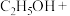 _______
_______ _______
_______ _______
_______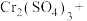 _______
_______ _______
_______
请配平上述反应的化学方程式
(2)某化学兴趣小组设计了如图所示装置,用电解法把
 转化为
转化为 。
。
A为
 的移动方向为:左
的移动方向为:左 在阳极区产生的原理为
在阳极区产生的原理为 。
。
您最近一年使用:0次
名校
解题方法
5 . 在强碱中氢氧化铁可被一些氧化剂氧化为高铁酸根离子( ),
), 在酸性条件下氧化性极强且不稳定。隔膜电解法制备
在酸性条件下氧化性极强且不稳定。隔膜电解法制备 的工作原理如图所示。下列说法错误的是
的工作原理如图所示。下列说法错误的是
 ),
), 在酸性条件下氧化性极强且不稳定。隔膜电解法制备
在酸性条件下氧化性极强且不稳定。隔膜电解法制备 的工作原理如图所示。下列说法错误的是
的工作原理如图所示。下列说法错误的是
| A.隔膜为阳离子交换膜 |
| B.由于阴极区产KOH,故电解过程中不需要额外补充 |
C.Fe电极上的反应为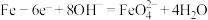 |
D.电路中每转移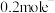 ,Pt电极上理论上产生2.24L气体(标准状况) ,Pt电极上理论上产生2.24L气体(标准状况) |
您最近一年使用:0次
2024-01-21更新
|
281次组卷
|
3卷引用:黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题
黑龙江省大庆实验中学实验三部2023-2024学年高三上学期阶段考试(二)化学试题(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)海南省海南中学2023-2024学年高三下学期第6次月考化学试题
名校
解题方法
6 . 工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+ (高浓度)>H+> Ni2+(低浓度)
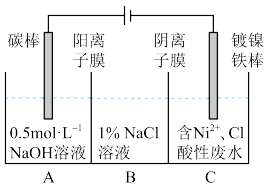
| A.碳棒上发生的电极反应:4OH- -4e- =O2↑+2H2O |
| B.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |
| C.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小 |
| D.为了提高Ni的产率,电解过程中需要控制废水pH |
您最近一年使用:0次
2022-11-10更新
|
995次组卷
|
67卷引用:2016-2017学年湖北省华中师范大学第一附属中学高二上学期期末考试化学试卷
2016-2017学年湖北省华中师范大学第一附属中学高二上学期期末考试化学试卷2016-2017学年江西省南昌市第二中学高二上学期期末考试化学试卷黑龙江省大庆第一中学2017-2018学年高二上学期期末(第四次月考)考试化学试题甘肃省兰州市第五十八中学2018-2019学年高二(理科)第一学期期末考试化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题17 带隔膜的电化学装置四川省成都市射洪县2018-2019学年高二下学期期末能力素质监测理综化学试题(英才班)(已下线)期末综合测试卷01-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)陕西省西安市2023-2024学年高二上学期期末化学测试卷B宁夏吴忠中学2023-2024学年高二上学期期末考试化学试题广东省汕头市金山中学2023-2024学年高二上学期期末考试 化学试题2015届浙江省台州中学高三上学期第三次统练考试理综试卷2015届浙江省台州中学高三上学期第三次统练理综化学试卷2015届福建省漳州市高三5月适应性考试化学试卷2015-2016学年山西省怀仁一中高二12月月考化学试卷2017届浙江省温州中学高三上10月高考模拟化学试卷2016-2017学年浙江省绍兴一中高二上期中化学试卷2016-2017学年湖南省衡阳八中高二上月考五化学卷2017届江苏省泰州中学高三下学期期初考试化学试卷2016-2017学年湖南省衡阳市第八中学高一下学期理科实验班第一次月考理科综合化学试卷2017届重庆市万州区高三下学期“二诊”模拟考试化学试卷2016-2017学年四川省成都市第七中学高二下学期半期考试化学试卷福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题辽宁省瓦房店市高级中学2017-2018学年高二上学期12月月考化学试题(已下线)黄金30题系列++高二化学(选修4)++++小题好拿分【基础版】山东省临沂市第十九中学2017-2018学年高二上学期第五次质量调研化学试题四川省什邡中学2017-2018学年高二春秋招班第三次月考化学试题(已下线)2018年9月23日 《每日一题》 一轮复习-每周一测高二人教版选修4 第四章 重难点专题练——原电池和电解池的综合应用【全国百强校】河北省石家庄市第一中学2018-2019学年高二上学期期中考试化学试题【全国百强校】河北省冀州市中学2018-2019学年高二上学期第六次月考化学试题【全国百强校】贵州省遵义航天高级中学2018-2019学年高二下学期第三次月考化学试题(已下线)2019年9月22日 《每日一题》 2020年高考一轮复习-每周一测浙江省嘉兴市第一中学、湖州中学2019-2020学年高二上学期期中联考化学试题重庆一中2019-2020学年高二上学期期中考试化学试题河南省洛阳市第一高级中学2019-2020学年高二12月月考化学试题湖南省邵阳市邵东县创新实验学校2020届高三上学期第五次月考化学试题云南省曲靖二中2020届高三第一次月考理综化学试题(已下线)【南昌新东方】2018-2019莲塘一中 高三12月 014鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第3节 电能转化为化学能——电解 课时2 电解原理的应用高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时2 电解原理的应用(已下线)【浙江新东方】47人教版(2019)高二化学选择性必修1第四章 化学反应与电能 易错疑难集训(二)(已下线)第四章 检测-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)福建省福州市第四中学2021届高三上学期11月月考化学试题重庆市沙坪坝区重庆市第七中学2020-2021高二上学期中考试化学试题湖北省孝感市高级中学2020—2021学年高二下学期2月调研考试化学试题河北正定中学2020-2021学年高三第二次半月考化学试题河北省衡水市武强中学2022届高三上学期第一次月考化学试题(已下线)专题08 电化学之电解池-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)第六单元 化学反应与能量(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)4.2.2 电解原理的应用-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)专题30 电化学中的交换膜-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)辽宁省朝阳市建平县实验中学2021-2022学年高二上学期第三次月考化学试题江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题山西省晋城市第一中学2021-2022学年高二上学期12月月考化学试题江西省宜春市上高二中2021-2022学年高二下学期第四次月考试题(3月)化学试题云南省曲靖市罗平县第五中学2021-2022学年高二4月月考化学试题四川省绵阳南山中学2021-2022学年高二下学期期中考试化学试题内蒙古喀喇沁旗锦山蒙古族中学2021-2022学年高二下学期开学考试化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题辽宁省实验中学2022-2023学年高二上学期期中阶段测试化学试题吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)专题08 新型化学电源(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题(已下线)选择题11-16河北省石家庄二中润德2023-2024学年高二上学期12月月考化学试题四川省什邡中学2023-2024学年高二下学期4月第一次月考化学试题
7 . 如图1是元素周期表的一部分。回答下列问题:
(1)硒是人体必需的微量元素。
① 与
与 互称为
互称为_______ 。
②硒元素的气态氢化物的化学式为_______ 。
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
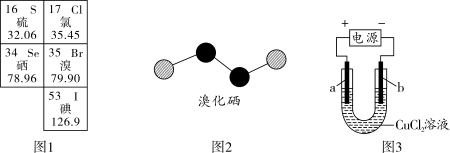
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是_______ (填字母)。
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是_______ 。
②a电极上的电极反应式为_______ 。
(4)下列事实不能说明氯的非金属性比硫强的是_______ (填字母)。
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强

(1)硒是人体必需的微量元素。
①
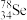 与
与 互称为
互称为②硒元素的气态氢化物的化学式为
(2)溴被称为海洋元素。
①溴元素在周期表中的位置为
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③溴化硒是一种重要的电子元件材料,其分子的球棍模型如图2所示。下列说法正确的是
a.溴化硒属于离子化合物 b.原子半径:r(Se)>r(Br)
c.Se元素的非金属性比Br的强 d.溴化硒的相对分子质量为317.72
(3)氯是卤族元素之一,电解氯化铜溶液可以得到Cl2,实验装置如图3所示。(已知a、b均为石墨电极)
①分别用湿润的淀粉碘化钾试纸置于a、b上方,可观察到的现象是
②a电极上的电极反应式为
(4)下列事实不能说明氯的非金属性比硫强的是
a.化合物SCl2中硫显正价而氯显负价
b.热稳定性:HCl>H2S
c.将氯气通入Na2S溶液中,有淡黄色沉淀生成
d.次氯酸的氧化性比稀硫酸的氧化性强
您最近一年使用:0次
8 . 工业上用电解法处理含镍酸性废水并回收得到单质Ni的原理如图所示。下列说法正确的是
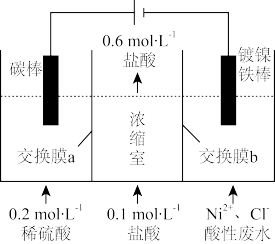
已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)

已知:①Ni2+在弱酸性溶液中发生水解;②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
| A.交换膜a为阴离子交换膜 |
| B.阳极的电极反应式为:2H2O-4e-=O2↑+4H+ |
| C.为了提高Ni的产率,电解过程中需要控制废水pH |
| D.若浓缩室得到1 L 0.6 mol·L-1的盐酸,阴极回收得到的镍为14.75g |
您最近一年使用:0次
名校
9 . 某研究小组用甲烷燃料电池作为电源,进行电解实验的相关研究。

(1)若乙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_____ 。
(2)若用乙装置给铜件镀银,电镀液是____ 溶液。电镀前a、b两电极质量相等,当甲池中消耗标况下1.12L甲烷时,a、b两电极质量相差____ g。
(3)若用乙装置电解CuCl2溶液,a、b电极均为碳棒,实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl。
为探究阴极碳棒上附着的红色、白色物质,设计了如图实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入如图所示装置b中,进行实验。

实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g。
①碳棒上的红色物质是_____ 。
②装置b中发生反应的化学方程式是____ 。
③电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为_____ 。
④保持电流强度为a安培,电解时间为T秒,经测定,得到红色物质质量为12.8g,白色物质质量为9.95g,计算该装置在本次电解中的电流效率η=_____ (化成最简式)。
(设:法拉第常数为F,单位为C•mol-1;η= ×100%)
×100%)

(1)若乙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
| A.a电极为纯铜 | B.粗铜接电源正极,发生还原反应 |
| C.CuSO4溶液的浓度保持不变 | D.利用阳极泥可回收Ag、Pt、Au等金属 |
(3)若用乙装置电解CuCl2溶液,a、b电极均为碳棒,实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
为探究阴极碳棒上附着的红色、白色物质,设计了如图实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入如图所示装置b中,进行实验。

实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g。
①碳棒上的红色物质是
②装置b中发生反应的化学方程式是
③电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为
④保持电流强度为a安培,电解时间为T秒,经测定,得到红色物质质量为12.8g,白色物质质量为9.95g,计算该装置在本次电解中的电流效率η=
(设:法拉第常数为F,单位为C•mol-1;η=
 ×100%)
×100%)
您最近一年使用:0次
名校
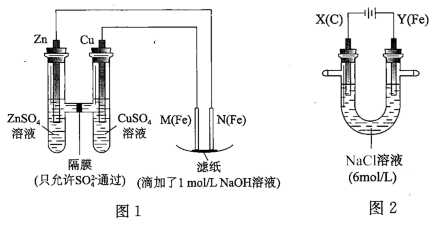
10 . 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是__ (填字母序号)。
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为__ 。
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH__ (填“增大”“减小”或“不变”)。
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少____ g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为__ 。

请回答:
Ⅰ.用图 1 所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是
A 铝 B 石墨 C 银 D 铂
(2)N 极发生反应的电极反应式为
Ⅱ.用图 2 所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(3)电解过程中,X 极区溶液的 pH
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣= FeO42-+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Z=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为
您最近一年使用:0次
2019-06-28更新
|
411次组卷
|
21卷引用:吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题
吉林省扶余市第一中学2017-2018学年高一下学期期末考试化学试题云南省迪庆州香格里拉中学2019-2020学年高二上学期期末考试化学试题云南省武定民族中学2019-2020学年高二上学期期末考试化学试题云南省普洱市镇沅县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市江城县第一中学2019—2020学年高二上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高二上学期期末考试化学试题贵州省三都水族自治县高级中学2019-2020学年高二上学期期末考试化学试题贵州省岑巩县第二中学2019-2020学年高二上学期期末考试化学试题贵州省三穗县三中2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县第二中学2019-2020学年高二上学期期末考试化学试题云南省昆明市寻甸县第三中学2019-2020学年高二上学期期末考试化学(已下线)《2018-2019学年同步单元双基双测AB卷》第四单元 电化学基础单元测试A卷云南省广南二中2018-2019学年高二6月考试化学试题云南省屏边县民族中学2019-2020学年高二上学期12月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题云南省镇康县第一中学2019-2020学年高二12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题2黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题安徽省怀宁中学2020-2021学年高二上学期第二次质量检测(普通班)化学试题云南省玉溪市江川区第二中学2020-2021学年高二下学期期中考试化学试题云南省玉龙县第一中学2021-2022学年高二下学期3月份考试化学试题



