名校
解题方法
1 . 绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国有重要意义。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式_______________________ 。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
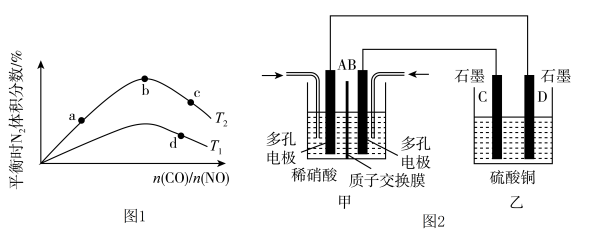
①b点时,平衡体系中C、N原子个数之比接近________________ ;
②a、b、c三点CO的转化率从大到小的顺序为_____________________ ;
③a、c、d三点的平衡常数从大到小的顺序为_________________ 。
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为________ 。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为___________________ 。
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为________________________ ,若向该溶液中加入一定量NaOH固体,使c(HC2O4- )=c(C2O42- ),则此时溶液呈________ (填“酸性”“碱性”或“中性”)。
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.4 kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234 kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.2 kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) ΔH=-759.8 kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
①b点时,平衡体系中C、N原子个数之比接近
②a、b、c三点CO的转化率从大到小的顺序为
③a、c、d三点的平衡常数从大到小的顺序为
④若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为25%,则CO的转化率为
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为
(4)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,25 ℃时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次
解题方法
2 . Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol–1。
CH3OH(g) ΔH=-90.8 kJ·mol–1。
(1)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270 ℃三种温度下合成甲醇的规律。
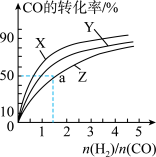
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_______ 。
Ⅱ.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
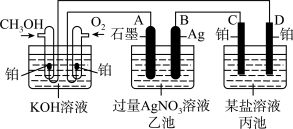
(2)乙池中A(石墨)电极的名称是______ 。
(3)通入CH3OH的电极的电极反应式为______ 。
(4)乙池中反应的化学方程式为_________
(5)当乙池中B(Ag)极的质量增加5.4 g时,甲池中理论上消耗O2________ mL(标准状况),此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________ (填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
 CH3OH(g) ΔH=-90.8 kJ·mol–1。
CH3OH(g) ΔH=-90.8 kJ·mol–1。(1)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270 ℃三种温度下合成甲醇的规律。

如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是
Ⅱ.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。

(2)乙池中A(石墨)电极的名称是
(3)通入CH3OH的电极的电极反应式为
(4)乙池中反应的化学方程式为
(5)当乙池中B(Ag)极的质量增加5.4 g时,甲池中理论上消耗O2
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
您最近一年使用:0次
2010·北京东城·二模
名校
解题方法
3 . 如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
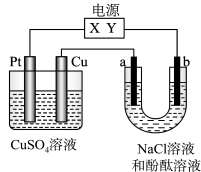

| A.X极是电源负极,Y极是电源正极 |
| B.a极的电极反应是2Cl--2e-=Cl2↑ |
| C.电解过程中CuSO4溶液的pH逐渐增大 |
| D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体 |
您最近一年使用:0次
2020-04-24更新
|
288次组卷
|
12卷引用:辽宁省营口中学2017-2018学年高二上学期期末考试化学试题
辽宁省营口中学2017-2018学年高二上学期期末考试化学试题辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题(已下线)2010年北京市东城区高三第二次模拟考试(理综)化学部分(已下线)2014年高考化学指导冲关 第7练电化学原理练习卷(已下线)2014-2015学年浙江省杭州市西湖高级中学高二10月月考化学试卷江西省九江第一中学2017-2018学年高二上学期期末考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高二上学期期末考试化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】江西省九江第一中学2017-2018学年高二上学期期末考试化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)热点题型训练 电化学串联装置的两大模型山东省菏泽市单县二中2022-2023学年高一下学期6月段考化学试题
名校
解题方法
4 . 某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为________ 极;实验过程中,SO42-____________ (填“从左向右”、“从右向左”或“不”)移动。
(2)反应初期,y极的电极反应现象为________________ ;检验y极反应产物的方法是________________ 。
(3)Cu极的电极反应式为____________ 。
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为__________ 。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________ g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为________ 。

请回答:
Ⅰ.用图1所示装置进行第一组实验(K闭合)。
(1)Zn极为
(2)反应初期,y极的电极反应现象为
(3)Cu极的电极反应式为
(4)Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。电解过程中,X极的电极反应式为
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和4OH--4e-=2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2该电池正极发生反应的电极反应式为
您最近一年使用:0次
2020-01-02更新
|
229次组卷
|
2卷引用:辽宁省丹东市2018-2019学年高一上学期期末质量监测化学试题
名校
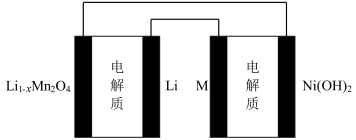
5 . 某充电宝锂离子电池的总反应为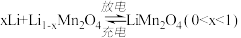 。某手机镍氢电池总反应为
。某手机镍氢电池总反应为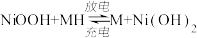 (M为储氢金属或合金),有关上述两种电池的说法错误的是
(M为储氢金属或合金),有关上述两种电池的说法错误的是
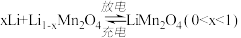 。某手机镍氢电池总反应为
。某手机镍氢电池总反应为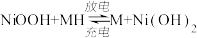 (M为储氢金属或合金),有关上述两种电池的说法错误的是
(M为储氢金属或合金),有关上述两种电池的说法错误的是
| A.锂离子电池放电时,Li+移向正极 |
| B.如图表示用锂离子电池给镍氢电池充电 |
C.锂离子电池充电时,阴极的电极反应式: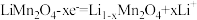 |
D.镍氢电池放电时,正极的电极反应式: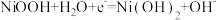 |
您最近一年使用:0次
2019-12-23更新
|
213次组卷
|
11卷引用:【全国省级联考】辽宁省部分重点高中2019届高三9月联考化学试题
【全国省级联考】辽宁省部分重点高中2019届高三9月联考化学试题2015届浙江省温州市高三一模理综化学试卷2016届河南省信阳市高三上学期期末质检化学试卷吉林省白城市第一中学2018-2019学年高二上学期第一次月考化学试题【全国百强校】河南省新乡市三校联考2019届高三上学期第二次月考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高一下学期第二次考试化学试题河南省实验中学2019-2020学年高二10月月考化学试题步步为赢 高二化学寒假作业:作业十二 原电池原理及其应用山东省实验中学2020届高三上学期第二次诊断考试化学试题(已下线)1.2.3 电解池的工作原理及应用(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)福建省福州市第十一中学2020-2021学年高二上学期期中质量检测化学试题
6 . 纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
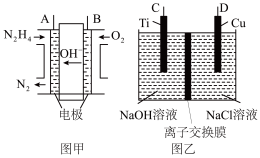
(1)上述装置中D电极应连接肼燃料电池的________ 极(填“A”或“B”),该电解池中离子交换膜为________ 离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为________________________________________ ,
肼燃料电池中A极发生的电极反应为____________________________ 。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。

(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阳极反应式为
肼燃料电池中A极发生的电极反应为
(3)当反应生成14.4 g Cu2O时,至少需要肼
您最近一年使用:0次
2019-11-19更新
|
195次组卷
|
6卷引用:辽宁省六校协作体2019-2020学年高二上学期期中考试化学试题
辽宁省六校协作体2019-2020学年高二上学期期中考试化学试题江苏省苏州市相城区陆慕高级中学2019-2020高二下学期4月质量检测化学试题黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题(已下线)综合复习与测试(1)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)河北定州中学2023-2024学年高二上学期12月月考化学试题山西省朔州市怀仁市大地学校高中部2023-2024学年高二上学期12月月考化学试题
11-12高三上·北京东城·期末
名校
7 . 如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是( )
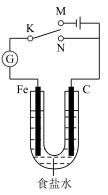

| A.若电键K与N连接,铁被保护不会腐蚀 |
| B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑ |
| C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜 |
| D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH |
您最近一年使用:0次
2019-10-16更新
|
345次组卷
|
12卷引用:2010—2011学年辽宁大连23中高一下学期期末考试化学试卷
(已下线)2010—2011学年辽宁大连23中高一下学期期末考试化学试卷(已下线)2011届北京市东城区高三第一学期期末考试化学试卷(已下线)2012届河南省南阳市高三上学期期末质量评估化学试卷(已下线)2013-2014学年湖北省武汉二中高二上学期期中考试化学试卷(已下线)2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(已下线)2013-2014湖北省武汉二中上学期期中考试高二化学试卷2015—2016学年河南省郑州一中高二上学期期末考试化学试卷广东省中山市第一中学2017-2018学年高二上学期第三次统测化学试题河北省唐山一中2019-2020学年高二上学期10月月考化学试题高中必刷题高二选择性必修1第四章 化学反应与电能 第二节 电解池 课时1 电解原理湖北省黄冈市麻城市第二中学2020-2021学年高二上学期期中考试化学试题选择性必修1专题1第二单元 课时3 电解原理
8 . 如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。

(1)甲装置中,Zn电极发生______ 反应(填“氧化”或“还原”),溶液中Cl-向_____ 极(填“Zn”或“Cu”)移动,Zn电极反应式为_______ ,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________ 。
(2)乙装置中,石墨电极C1是_______ 极,现象是______ ,C2极电极反应式为_______ ,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________ 。

(1)甲装置中,Zn电极发生
(2)乙装置中,石墨电极C1是
您最近一年使用:0次
2019-06-06更新
|
228次组卷
|
4卷引用:辽宁省大连市普兰店市第一中学2019-2020学年高二上学期期末考试化学试题
名校
解题方法
9 . (1)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应式为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为 ______ ;放电时正极附近溶液的碱性____ (填“增强”。“不变“或“减弱”)。
(2)三元锂电池是以镍钴锰为正极材料的新型电池,镍钴锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-nMO2,Ni、Co、Mn三种元素分别显+2、+3、+4价。其充电 时总反应为:LiMO2+C6 Li1-nMO2+LinC6。
Li1-nMO2+LinC6。
①充放电电时,电解液的主要作用________________________________________ 。
②在Li1-nMO2材料中,若x︰y︰z=2︰3︰5,则n=______________ 。
③放电时,正极反应为:__________________________ 。
④充电时,当转移0.2amol电子,负极材料减重_____________ g。
 3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH,原电池负极的电极反应式为 (2)三元锂电池是以镍钴锰为正极材料的新型电池,镍钴锰材料可表示为Li1-nNixCoyMnzO2,x+y+z=1,通常简写为Li1-nMO2,Ni、Co、Mn三种元素分别显+2、+3、+4价。其
 Li1-nMO2+LinC6。
Li1-nMO2+LinC6。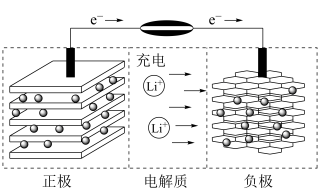
①充放电电时,电解液的主要作用
②在Li1-nMO2材料中,若x︰y︰z=2︰3︰5,则n=
③放电时,正极反应为:
④充电时,当转移0.2amol电子,负极材料减重
您最近一年使用:0次
名校
10 . 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
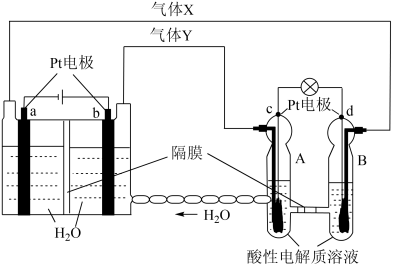

| A.当有0.8mol电子转移时,b极产生4.48LO2 |
| B.为了增加导电性可以将左边容器中的水改为NaOH溶液 |
| C.d极上发生的电极反应是:2H+ +2e-=H2 |
| D.c极上进行氧化反应,A池中的H+可以通过隔膜进入B |
您最近一年使用:0次
2019-05-10更新
|
1064次组卷
|
5卷引用:辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题



