1 .  一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
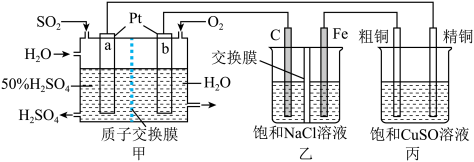
(1)a极的电极反应式为___________ ;Fe电极为___________ 极,其电极反应式为___________ 。
(2)甲装置每消耗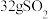 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为___________ mol,如果粗铜中含有锌、银等杂质,丙装置中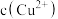
___________ (填“增大”“减小”或“不变”)。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。
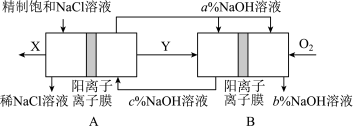
装置A发生反应的化学方程式为___________ ;图中X的化学式为___________ ;NaOH溶液的质量分数为a%、b%、c%,由大到小的顺序为___________ 。
 一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
一空气燃料电池实现了制硫酸、发电、环保三位一体的结合,某实验小组用该燃料电池作电源探究氯碱工业和粗铜精炼的原理,装置示意图如下:
(1)a极的电极反应式为
(2)甲装置每消耗
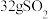 ,溶液中通过质子交换膜的
,溶液中通过质子交换膜的 为
为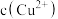
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。该工艺的相关物质运输与转化关系如图所示(电极未标出)。

装置A发生反应的化学方程式为
您最近半年使用:0次
名校
2 .  、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。
(1)25℃,101kPa时,8.0g 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:___________ 。
(2)水煤气中的CO和 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: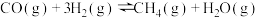 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。

①从反应开始到6分钟,CO的平均反应速率___________ ,6分钟时,H2的转化率为___________ 。
②下列叙述中能说明上述反应达到化学平衡状态的是___________ 。(填字母)
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中 的质量分数保持不变
的质量分数保持不变
d.单位时间内每消耗1molCO,同时生成1mol
(3)甲烷燃料电池装置图如图-2,电池总反应为 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。
①通入氧气的电极为电池的___________ (填“正极”或“负极”)
②若通入0.1mol 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。___________ 。
 、CO、
、CO、 等都是重要的能源,也是重要的化工原料。
等都是重要的能源,也是重要的化工原料。(1)25℃,101kPa时,8.0g
 完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:
完全燃烧生成二氧化碳气体和液态水放出445.1kJ热量。写出该反应的热化学反应方程式:(2)水煤气中的CO和
 在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应:
在高温下反应可生成甲烷。在体积为2L的恒容密闭容器中,充入1molCO和5molH2,一定温度下发生反应: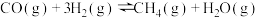 。测得CO和H2的转化率随时间变化如图-1所示。
。测得CO和H2的转化率随时间变化如图-1所示。
①从反应开始到6分钟,CO的平均反应速率
②下列叙述中能说明上述反应达到化学平衡状态的是
a.容器中混合气体的密度保持不变
b.容器中混合气体的总压强保持不变
c.容器中
 的质量分数保持不变
的质量分数保持不变d.单位时间内每消耗1molCO,同时生成1mol

(3)甲烷燃料电池装置图如图-2,电池总反应为
 。现用此燃料电池电解饱和食盐水。
。现用此燃料电池电解饱和食盐水。①通入氧气的电极为电池的
②若通入0.1mol
 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢气的体积(标准状况下)。写出计算过程,否则不得分。
您最近半年使用:0次
2021-06-28更新
|
286次组卷
|
2卷引用:江苏省连云港市2020-2021学年高一下学期期末调研考试化学试题
名校
3 . 利用氧化还原反应可以解决很多实际问题:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O
(1)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol/L盐桥中装有饱和溶液。K2SO4回答下列问题:
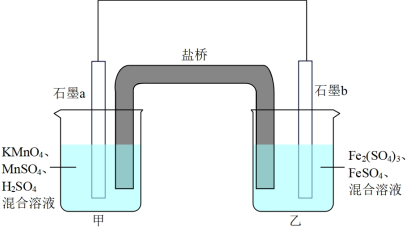
①发生氧化反应的烧杯是_______ (填“甲”或“乙”)。
②甲烧杯中发生的电极反应_______ 。
(2)工业上处理含Cr2O 的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
①电解时的电极反应:阴极_______ 。
②Cr2O 转变成Cr3+的离子反应方程式:
转变成Cr3+的离子反应方程式:_______ 。
(3)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
①放电时负极的电极反应为:_______ ;
②充电时有CH3OH生成的电极为_______ 极; 填“阴极”或阳极
填“阴极”或阳极 充电时每生成1 molCH3OH转移
充电时每生成1 molCH3OH转移_______ mol电子
(4)通过NOx传感器可监测NOx的含量,工作原理示意图如图所示,写出NiO电极的电极反应式:_______ 。

(1)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol/L盐桥中装有饱和溶液。K2SO4回答下列问题:

①发生氧化反应的烧杯是
②甲烧杯中发生的电极反应
(2)工业上处理含Cr2O
 的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。
的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。①电解时的电极反应:阴极
②Cr2O
 转变成Cr3+的离子反应方程式:
转变成Cr3+的离子反应方程式:(3)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
①放电时负极的电极反应为:
②充电时有CH3OH生成的电极为
 填“阴极”或阳极
填“阴极”或阳极 充电时每生成1 molCH3OH转移
充电时每生成1 molCH3OH转移(4)通过NOx传感器可监测NOx的含量,工作原理示意图如图所示,写出NiO电极的电极反应式:

您最近半年使用:0次
名校
解题方法
4 . 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
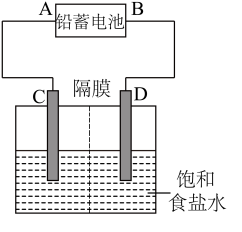
铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
(1)铅蓄电池放电时的正极反应为___ 。
(2)请写出电解饱和食盐水的化学方程式:____ 。
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为___ 极。
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子____ mol。
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为___ L。
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)___ (用含a的代数式表示)。

铅蓄电池充、放电时的电池反应为:Pb+PbO2+2H2SO4
 2PbSO4+2H2O
2PbSO4+2H2O(1)铅蓄电池放电时的正极反应为
(2)请写出电解饱和食盐水的化学方程式:
(3)若在电解池C极一侧滴入几滴酚酞溶液,电解一段时间后溶液变红色,说明铅蓄电池的A极为
(4)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g·cm-3)时,
①若收集到11.2L(标准状况下)氯气,则至少转移电子
②若铅蓄电池消耗2molH2SO4,则可收集到H2的体积(标准状况下)为
③若蓄电池消耗amol硫酸,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气和氢气全部排出)
您最近半年使用:0次
2020-05-13更新
|
110次组卷
|
2卷引用:山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题
名校
解题方法
5 . 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
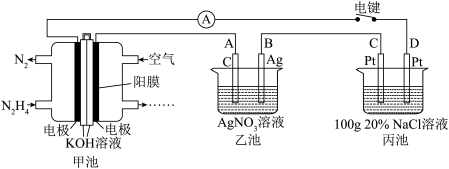
请回答下列问题 :
(1)甲池中,右室的KOH的作用是_________ 。当有l mol电子经过外电路时,左室中减少_______ mol 离子。
(2)乙池中A电极的名称为________ (填“正极”“负极”“阴极”或“阳极”),其电极反应式为________ ,电键闭合10min后,B极质量增加4.32g, 甲池中理论上消耗空气的体积为_____________ mL(标准状况下,假设O2占空气的体积分数为20%),若要使乙池中的电解质溶液完全恢复原状,则加入的试剂可以是:_________ 。
(3)电键闭合10 min 后, D电极附近的pH 将________ (填“增大”“减小”或“不变”);若C电极上产生的气体,用丙池反应后的溶液将其完全吸收,则生成的消毒液的有效成分的质量分数为____________ 。(用算式表示,不要求计算结果,但有单位的数据须带上单位。)

请回答下列问题 :
(1)甲池中,右室的KOH的作用是
(2)乙池中A电极的名称为
(3)电键闭合10 min 后, D电极附近的pH 将
您最近半年使用:0次
真题
名校
6 . 请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______ (要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________ (填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
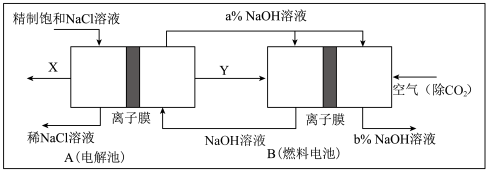
①图中X、Y分别是_____ 、_______ (填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________ ;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______ ;负极:_____ ;
③这样设计的主要节(电)能之处在于(写出2处)____________ 、____________ 。
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是
②分别写出燃料电池B中正极、负极上发生的电极反应正极:
③这样设计的主要节(电)能之处在于(写出2处)
您最近半年使用:0次
2016-12-09更新
|
192次组卷
|
7卷引用:2009年高考真题汇编-卤 素
2009年高考真题汇编-卤 素(已下线)2011-2012学年河南省平顶山市高一上学期期末调研考试化学试卷2016-2017学年江苏省如东高级中学高一下学期第一次(3月)阶段检测化学试卷2009年普通高等学校招生统一考试理综试题化学部分(宁夏卷)(已下线)2010年陕西省五校高三第一次模拟考试理综化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题
10-11高一下·江苏盐城·期末
7 . 铅蓄电池属于二次电池,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸,工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;PbSO4不溶。
(1)该蓄电池工作时负极的电极反应式为_______________________________________
(2)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量_________ (增加、减少)_________ 克;如果要求将CuSO4溶液恢复成与开始时完全相同,则可以加入下列物质中的___________
E.Cu固体 F. Cu2(OH) 2CO3固体
(3)若用该蓄电池作电源(都用惰性材料做电极)电解400克饱和食盐水,如果电池内硫酸的的体积为5升,当其浓度从1.5mol/L降至1.3mol/L时,计算剩余溶液中氯化钠的质量分数_________ (该温度下氯化钠的溶解度为32克)。
(1)该蓄电池工作时负极的电极反应式为
(2)将质量相等的铁棒和石墨棒分别插入CuSO4溶液中,铁棒接该蓄电池Pb极,石墨棒接该蓄电池PbO2极,一段时间后测得铁棒比石墨棒增加了3.2克,则CuSO4溶液质量
| A.CuSO4溶液 | B.CuCO3固体 | C.CuO固体 | D.Cu(OH)2固体 |
E.Cu固体 F. Cu2(OH) 2CO3固体
(3)若用该蓄电池作电源(都用惰性材料做电极)电解400克饱和食盐水,如果电池内硫酸的的体积为5升,当其浓度从1.5mol/L降至1.3mol/L时,计算剩余溶液中氯化钠的质量分数
您最近半年使用:0次



