名校
解题方法
1 . 高纯镓是制备第三代半导体的重要原料,其化学性质与铝相似。下图为工业精炼镓的装置示意图。下列说法不正确的是

A.阴极的电极反应为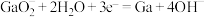 |
B.电解过程中,阳极室中 的物质的量减小 的物质的量减小 |
C.电路中每转移 电子,理论上粗镓熔融液减少 电子,理论上粗镓熔融液减少 |
D.电解后粗镓中的 以离子形式进入 以离子形式进入 溶液中 溶液中 |
您最近一年使用:0次
2024-03-01更新
|
680次组卷
|
5卷引用:广东省广州市第二中学2023-2024学年高三上学期期末化学试卷
广东省广州市第二中学2023-2024学年高三上学期期末化学试卷(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)吉林省长春市东北师范大学附属中学2024届高三下学期第五次模拟考试化学试题河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题黑龙江省哈尔滨工业大学附属中学校2024届高三下学期五模化学试题
名校
解题方法
2 . 某小组采用电化学法制备有机物,装置如图所示。双极膜是由阴膜和阳膜组成的,双极膜中水电离出的阴、阳离子在电场中向两极迁移。下列叙述正确的是

| A.a极与电源负极连接 |
B.制备1mol 时双极膜内质量减少18g 时双极膜内质量减少18g |
C.b极的电极反应式为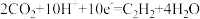 |
D.每转移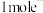 ,生成 ,生成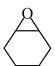 、 、 的物质的量之比为1:5 的物质的量之比为1:5 |
您最近一年使用:0次
2024-02-02更新
|
425次组卷
|
4卷引用:广东省湛江市2023-2024学年高三上学期1月期末化学试题
广东省湛江市2023-2024学年高三上学期1月期末化学试题福建省厦门第一中学2023-2024学年高三下学期2月第一次月考化学试卷(已下线)化学(天津卷03)-2024年高考化学押题预测卷河南省TOP二十名校2024届高三下学期5月冲刺(一)理综试卷-高中化学
名校
解题方法
3 . 一种微生物电解生产甲烷的装置如图所示。下列有关说法正确的是

A.电极 应与电源的负极相连 应与电源的负极相连 |
B.电极 上的反应式为: 上的反应式为: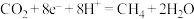 |
| C.提高温度一定能提高电解反应的速率 |
D.电解时 通过质子交换膜移向电极 通过质子交换膜移向电极 |
您最近一年使用:0次
2023-12-14更新
|
280次组卷
|
3卷引用:广东省江门市新会第一中学2023-2024学年高二上学期期末考试化学试题
名校
4 . 电镀实验在生产生活中应用广泛。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是___________ (填阴极或阳极),对应的电极方程式为:___________ ;如图装置电解一段时间后,溶液中___________ (填微粒化学式)浓度下降,从而影响镀铜的速率和质量。
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
(2)实验①中,无色气体产生的原因是 或
或___________ 。
(3)实验①中,气体减少,推测是由于溶液中 减少,且
减少,且___________ 。
(4)欲测定实验①溶液中 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的___________ ,用 标准溶液滴定时应选用
标准溶液滴定时应选用___________ 滴定管(填“酸式”或“碱式”)。
(5)为确定实验①电解质溶液中 的准确浓度
的准确浓度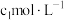 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用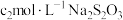 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: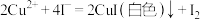 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为___________ ,滴定终点观察到的现象为:当滴入最后半滴标准溶液时,锥形㼛中溶液___________ 。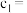
___________ (用 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果___________ (填“偏大”“偏小”或“无影响”)。
(6)实验②中, 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为___________ ,反应后的体系呈___________ 色。
Ⅰ.某实验小组设计了如图在纽扣上电镀铜的实验装置:

(1)如图中,石墨是
Ⅱ.实验小组利用如图装置进行铁上电镀铜的实验探究:
| 装置示意图 | 序号 | 电解质溶液 | 实验现象 |
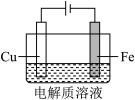 | ① | 0.1mol/L +少量 +少量 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验,铁电极表面有 生成。 生成。 |
| ② | 0.1mol/L +过量氨水 +过量氨水 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体,经检验,电解液中无Fe元素。 |
 或
或(3)实验①中,气体减少,推测是由于溶液中
 减少,且
减少,且(4)欲测定实验①溶液中
 的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线
的浓度,需要用容量瓶配制某标准溶液,定容时当液面离容量瓶颈部的刻度线 时,改用胶头滴管滴加蒸馏水至溶液的
时,改用胶头滴管滴加蒸馏水至溶液的 标准溶液滴定时应选用
标准溶液滴定时应选用(5)为确定实验①电解质溶液中
 的准确浓度
的准确浓度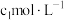 ,实验操作为:准确量取
,实验操作为:准确量取 含有
含有 的溶液于带塞锥形瓶中,调节溶液
的溶液于带塞锥形瓶中,调节溶液 ,加入过量的
,加入过量的 ,用
,用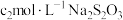 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。上述过程中反应的离子方程式:
。上述过程中反应的离子方程式: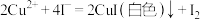 ,
, 。滴定选用的指示剂为
。滴定选用的指示剂为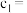
 、
、 、
、 等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果
等的代数式表示)。滴定终点时,某同学俯视读数,其他操作均正确,则测定结果(6)实验②中,
 与过量氨水反应的离子方程式为
与过量氨水反应的离子方程式为
您最近一年使用:0次
2023-07-13更新
|
158次组卷
|
2卷引用:广东省四校(华附,省实,广雅,深中)2022-2023学年高二下学期期末联考化学试题
解题方法
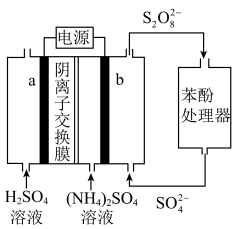
5 .  电化学循环氧化法可用于废水中苯酚降解成
电化学循环氧化法可用于废水中苯酚降解成 ,工作原理如图所示,下列说法正确的是
,工作原理如图所示,下列说法正确的是
 电化学循环氧化法可用于废水中苯酚降解成
电化学循环氧化法可用于废水中苯酚降解成 ,工作原理如图所示,下列说法正确的是
,工作原理如图所示,下列说法正确的是
A.电极 是阴极,发生还原反应 是阴极,发生还原反应 |
B.a电极的电极反应式为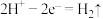 |
C.电解时, 通过阴离子交换膜从右向左迁移 通过阴离子交换膜从右向左迁移 |
D.电路中通过 电子时,理论上可处理 电子时,理论上可处理 苯酚 苯酚 |
您最近一年使用:0次
解题方法
6 . 含有硝酸盐和亚硝酸盐的酸性废水可导致水体富营养化,引发环境污染。如图是利用电化学原理处理 的原理,下列有关叙述错误的是
的原理,下列有关叙述错误的是

 的原理,下列有关叙述错误的是
的原理,下列有关叙述错误的是
A.直流电源为铅蓄电池时, 极连接Y电极 极连接Y电极 |
| B.Y电极发生还原反应 |
C.当产生 时,有 时,有 跨膜而过 跨膜而过 |
D.阳极电极反应方程式为: |
您最近一年使用:0次
解题方法
7 . 下列方程式正确的是
A.铁与稀硫酸反应的离子方程式: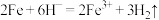 |
B.电解熔融 : : |
C.酸性高锰酸钾溶液和草酸溶液反应: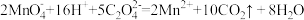 |
D.向氯水中加入碳酸钠: |
您最近一年使用:0次
解题方法
8 . 工业上 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:
反应Ⅰ:
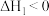
反应Ⅱ:

回答下列问题:
(1)已知: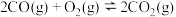

则反应

_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)关于反应Ⅰ,下列说法正确的有_______(填标号)。
(3)向恒压密闭装置中充入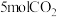 和
和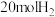 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量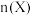 随温度
随温度 变化关系如图所示。
变化关系如图所示。

①曲线 对应物质为
对应物质为_______ (填化学式)。
② 达平衡时,
达平衡时, 的总转化率为
的总转化率为_______  。
。
③结合图像分析,达平衡时装置中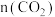 随温度升高的变化趋势为
随温度升高的变化趋势为_______ (填标号)。
A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是_______ 。
(4)采用下图装置能实现 电化学法制
电化学法制 ,同时获得副产物
,同时获得副产物 。
。

①铜电极的电极反应式为_______ 。
②每制得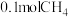 ,理论上
,理论上 电极生成
电极生成_______ 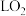 (折算为标准状况)。
(折算为标准状况)。
 加氢制
加氢制 ,为
,为 的减排与再利用提供了一种新策略,该过程中存在如下反应:
的减排与再利用提供了一种新策略,该过程中存在如下反应:反应Ⅰ:

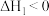
反应Ⅱ:


回答下列问题:
(1)已知:
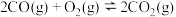

则反应


 、
、 、
、 的代数式表示)。
的代数式表示)。(2)关于反应Ⅰ,下列说法正确的有_______(填标号)。
| A.反应物的键能之和高于生成物的键能之和 |
| B.低温条件有利于该反应自发进行 |
| C.混合气体的平均摩尔质量不再改变,说明反应已达平衡 |
D.恒容条件下,充入更多的 能提高单位体积活化分子的百分数 能提高单位体积活化分子的百分数 |
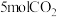 和
和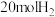 ,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得
,在不同温度下同时发生反应Ⅰ和Ⅱ,达平衡时,测得 和
和 的物质的量
的物质的量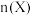 随温度
随温度 变化关系如图所示。
变化关系如图所示。
①曲线
 对应物质为
对应物质为②
 达平衡时,
达平衡时, 的总转化率为
的总转化率为 。
。③结合图像分析,达平衡时装置中
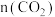 随温度升高的变化趋势为
随温度升高的变化趋势为A.减小 B.增大 C.先减小后增大 D.先增大后减小
④工业制备
 通常控制温度在
通常控制温度在 ℃之间的原因是
℃之间的原因是(4)采用下图装置能实现
 电化学法制
电化学法制 ,同时获得副产物
,同时获得副产物 。
。
①铜电极的电极反应式为
②每制得
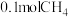 ,理论上
,理论上 电极生成
电极生成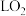 (折算为标准状况)。
(折算为标准状况)。
您最近一年使用:0次
解题方法
9 . 一种由我国科学家研发的水系 电池的结构及工作原理如图所示,其中电极
电池的结构及工作原理如图所示,其中电极 为碳电极,电极
为碳电极,电极 为掺有硫单质的碳电极。下列说法不正确的是
为掺有硫单质的碳电极。下列说法不正确的是
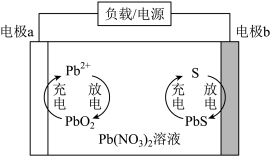
 电池的结构及工作原理如图所示,其中电极
电池的结构及工作原理如图所示,其中电极 为碳电极,电极
为碳电极,电极 为掺有硫单质的碳电极。下列说法不正确的是
为掺有硫单质的碳电极。下列说法不正确的是
A.放电时,电极 为负极 为负极 |
B.充电时,电极 发生反应: 发生反应: |
C.放电时,电极 附近溶液的 附近溶液的 逐渐减小 逐渐减小 |
D.充电时,每转移 电子,阴极质量理论上减少 电子,阴极质量理论上减少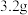 |
您最近一年使用:0次
10 . 近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”,将 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。
Ⅰ. 催化
催化 和
和 生产甲醇。
生产甲醇。
①

②

(1)已知:
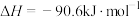 ,则
,则
________ 。
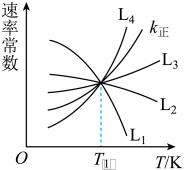
(2)已知:反应①的正反应速率可表示为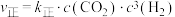 ,逆反应速率可表示为
,逆反应速率可表示为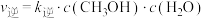 ,其中
,其中 、
、 为速率常数。图中能够代表
为速率常数。图中能够代表 的曲线为
的曲线为________ (填“ ”,“
”,“ ”、“
”、“ ”或“
”或“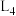 ”)。
”)。
(3)对于上述反应体系,下列说法正确的是________。
(4)不同条件下,按照 投料,
投料, 的平衡转化率如图所示。
的平衡转化率如图所示。

①压强 、
、 、
、 由大到小的顺序是
由大到小的顺序是________ ,压强为 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是________ 。
②图中点 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 占整个转化的
占整个转化的 的百分比)。则该温度时反应①的平衡常数
的百分比)。则该温度时反应①的平衡常数
________  (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。
Ⅱ.电化学法还原 制乙烯
制乙烯
在强酸性溶液中通入 ,用情性电极进行电解可制得乙烯。其原理如图所示:
,用情性电极进行电解可制得乙烯。其原理如图所示:
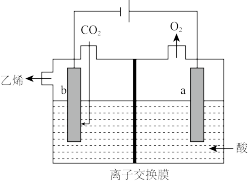
(5)阴极电极反应式为________ 。
 转化为高附加值化学品成为科学家研究的重要课题。
转化为高附加值化学品成为科学家研究的重要课题。Ⅰ.
 催化
催化 和
和 生产甲醇。
生产甲醇。①


②


(1)已知:

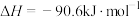 ,则
,则

(2)已知:反应①的正反应速率可表示为
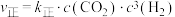 ,逆反应速率可表示为
,逆反应速率可表示为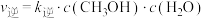 ,其中
,其中 、
、 为速率常数。图中能够代表
为速率常数。图中能够代表 的曲线为
的曲线为 ”,“
”,“ ”、“
”、“ ”或“
”或“ ”)。
”)。(3)对于上述反应体系,下列说法正确的是________。
A.增大 的浓度,反应①、②的正反应速率均增加,逆反应速率均减小 的浓度,反应①、②的正反应速率均增加,逆反应速率均减小 |
| B.恒容密闭容器中气体密度不变时,反应达到平衡状态 |
C.加入催化剂, 的平衡转化率不变 的平衡转化率不变 |
D.温度为 时,反应①的化学平衡常数 时,反应①的化学平衡常数 |
 投料,
投料, 的平衡转化率如图所示。
的平衡转化率如图所示。
①压强
 、
、 、
、 由大到小的顺序是
由大到小的顺序是 时,温度高于570℃之后,随着温度升高
时,温度高于570℃之后,随着温度升高 平衡转化率增大的原因是
平衡转化率增大的原因是②图中点
 ,此时压强
,此时压强 为0.1MPa,
为0.1MPa, 的选择性为
的选择性为 (选择性:转化的
(选择性:转化的 中生成
中生成 占整个转化的
占整个转化的 的百分比)。则该温度时反应①的平衡常数
的百分比)。则该温度时反应①的平衡常数
 (分压=总压
(分压=总压 物质的量分数)。
物质的量分数)。Ⅱ.电化学法还原
 制乙烯
制乙烯在强酸性溶液中通入
 ,用情性电极进行电解可制得乙烯。其原理如图所示:
,用情性电极进行电解可制得乙烯。其原理如图所示:
(5)阴极电极反应式为
您最近一年使用:0次
2023-07-02更新
|
200次组卷
|
2卷引用:广东省广州市天河区2022-2023学年高二下学期期末考试化学试题



