解题方法
1 . 对氨基苯磺酸是制备药物的重要中间体,可用苯胺( )、浓硫酸为原料合成。实验流程、装置示意图如下。
)、浓硫酸为原料合成。实验流程、装置示意图如下。
回答下列问题:
(1)仪器A的名称___________ 。
(2)写出该反应的化学方程式___________ 。
(3)步骤1中加热方式是___________ (填“水浴”、“油浴”或“直接加热”)。步骤1加入浓硫酸时,为防止温度过高致苯胺被氧化,可采取的措施有___________ 。
(4)下列有关说法正确的是________
(5)对氨基苯磺酸粗产品因含杂质而显色,可用重结晶法进行提纯。从下列选项中选择合理操作并排序:______
(___________)→(___________)→(___________)→(___________)→过滤→洗涤→干燥。
a.沸水溶解 b.过滤 c.趁热过滤 d.蒸发结晶 e.冷却结晶 f.加入活性炭
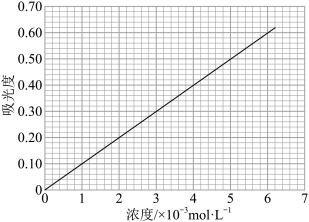
(6)对氨基苯磺酸与对二甲氨基苯甲醛在一定条件下可以发生显色反应。利用这一原理,用分光光度法可以测定对氨基苯磺酸的含量,吸光度与对氨基苯磺酸浓度关系如图所示。___________ 。
 )、浓硫酸为原料合成。实验流程、装置示意图如下。
)、浓硫酸为原料合成。实验流程、装置示意图如下。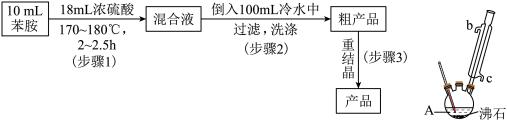
| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 苯胺 | 93 |  | 184 | 微溶于水,溶于乙醇、乙醚等有机溶剂 |
| 对氨基苯磺酸 | 173 | 288 | —— | 微溶于冷水,溶于热水,不溶于乙醇、乙醚等有机溶剂 |
(1)仪器A的名称
(2)写出该反应的化学方程式
(3)步骤1中加热方式是
(4)下列有关说法正确的是________
| A.反应产物中可能有邻氨基苯磺酸 |
| B.冷凝管进出水方向是b进a出 |
| C.如果加热后发现忘加沸石,应立刻补加 |
| D.步骤2将混合液倒入盛有冷水烧杯中,用玻璃棒摩擦器壁可促使晶体析出 |
(___________)→(___________)→(___________)→(___________)→过滤→洗涤→干燥。
a.沸水溶解 b.过滤 c.趁热过滤 d.蒸发结晶 e.冷却结晶 f.加入活性炭
(6)对氨基苯磺酸与对二甲氨基苯甲醛在一定条件下可以发生显色反应。利用这一原理,用分光光度法可以测定对氨基苯磺酸的含量,吸光度与对氨基苯磺酸浓度关系如图所示。
您最近半年使用:0次
2023-07-11更新
|
56次组卷
|
2卷引用:山西省运城市2022-2023学年高二下学期期末考试化学试题
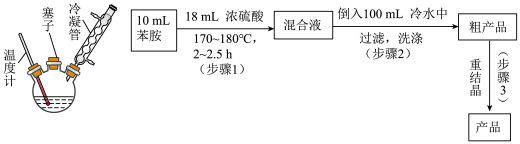
2 . 对氨基苯磺酸是制备药物的重要中间体,可用苯胺( )、浓硫酸为原料合成。实验装置示意图、实验流程如下。
)、浓硫酸为原料合成。实验装置示意图、实验流程如下。
相关数据如下表:
回答下列问题:
(1)步骤1中加热方式是____ (填“水浴”、“油浴”或“直接加热”)。
(2)写出该反应的化学方程式____ 。
(3)下列有关说法正确的是 。
(4)步骤1加入浓硫酸时,为防止温度过高致苯胺被氧化,可采取的措施有____ 。
(5)对氨基苯磺酸粗产品因含杂质而显色,可用重结晶法进行提纯。从下列选项中选择合理操作并排序:( )→( )→( )→( )→过滤→洗涤→干燥。____ 。
a.冷却结晶 b.蒸发结晶 c.趁热过滤 d.过滤 e.加入活性炭 f.沸水溶解
(6)对氨基苯磺酸与对二甲氨基苯甲醛在一定条件下可以发生显色反应。利用这一原理,用分光光度法可以测定对氨基苯磺酸的含量,吸光度与对氨基苯磺酸浓度关系如图所示。
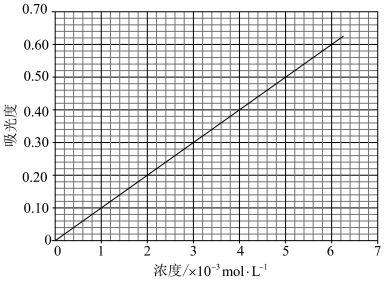
取1.00 g对氨基苯磺酸样品,配成1 L溶液,取样加入显色剂,测得吸光度为0.56。则样品中对氨基苯磺酸的质量分数是____ 。
 )、浓硫酸为原料合成。实验装置示意图、实验流程如下。
)、浓硫酸为原料合成。实验装置示意图、实验流程如下。
相关数据如下表:
名称 | 相对 分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯胺 | 93 | -6.2 | 184 | 微溶于水,溶于乙醇、乙醚等有机溶剂 |
| 对氨基苯磺酸 | 173 | 288 | -- | 微溶于冷水,溶于热水,不溶于乙醇、乙醚等有机溶剂 |
(1)步骤1中加热方式是
(2)写出该反应的化学方程式
(3)下列有关说法正确的是 。
| A.如果加热后发现忘加沸石,应立刻补加 |
| B.反应产物中可能有邻氨基苯磺酸 |
| C.为防止反应物逸出,冷凝管上口也应用塞子塞紧 |
| D.步骤2将混合液倒入盛有冷水烧杯中,用玻璃棒摩擦器壁可促使晶体析出 |
(5)对氨基苯磺酸粗产品因含杂质而显色,可用重结晶法进行提纯。从下列选项中选择合理操作并排序:( )→( )→( )→( )→过滤→洗涤→干燥。
a.冷却结晶 b.蒸发结晶 c.趁热过滤 d.过滤 e.加入活性炭 f.沸水溶解
(6)对氨基苯磺酸与对二甲氨基苯甲醛在一定条件下可以发生显色反应。利用这一原理,用分光光度法可以测定对氨基苯磺酸的含量,吸光度与对氨基苯磺酸浓度关系如图所示。

取1.00 g对氨基苯磺酸样品,配成1 L溶液,取样加入显色剂,测得吸光度为0.56。则样品中对氨基苯磺酸的质量分数是
您最近半年使用:0次
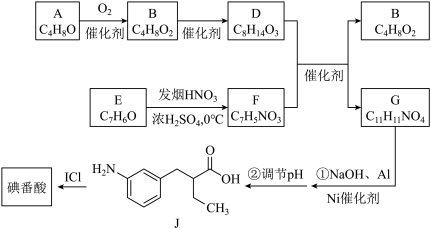
3 . 碘番酸是一种口服造影剂,用于胆部X—射线检查。其合成路线如下:
已知:R1COOH+R2COOH
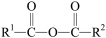 +H2O
+H2O
(1)A可发生银镜反应,A分子含有的官能团是___________ 。
(2)B无支链,B的名称是___________ 。B的一种同分异构体,其核磁共振氢谱只有一组峰,结构简式是___________ 。
(3)E为芳香族化合物,E→F的化学方程式是___________ 。
(4)G中含有乙基,G的结构简式是___________ 。
(5)碘番酸分子中的碘位于苯环上不相邻的碳原子上。碘番酸的相对分子质量为571,J的相对分子质量为193,碘番酸的结构简式是___________ 。
(6)口服造影剂中碘番酸含量可用滴定分析法测定,步骤如下。
步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I-,冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数___________ 。

已知:R1COOH+R2COOH

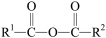 +H2O
+H2O (1)A可发生银镜反应,A分子含有的官能团是
(2)B无支链,B的名称是
(3)E为芳香族化合物,E→F的化学方程式是
(4)G中含有乙基,G的结构简式是
(5)碘番酸分子中的碘位于苯环上不相邻的碳原子上。碘番酸的相对分子质量为571,J的相对分子质量为193,碘番酸的结构简式是
(6)口服造影剂中碘番酸含量可用滴定分析法测定,步骤如下。
步骤一:称取amg口服造影剂,加入Zn粉、NaOH溶液,加热回流,将碘番酸中的碘完全转化为I-,冷却、洗涤、过滤,收集滤液。
步骤二:调节滤液pH,用bmol∙L-1AgNO3标准溶液滴定至终点,消耗AgNO3溶液的体积为cmL。
已知口服造影剂中不含其它含碘物质。计算口服造影剂中碘番酸的质量分数
您最近半年使用:0次
2022-09-08更新
|
8646次组卷
|
10卷引用:2022年北京市高考真题化学试题
2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题15-19(已下线)易错点28 烃-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十一 有机推断中的新发展北京市北京师范大学附属中学2022-2023 学年高三上学期月考2化学试题(已下线)2022年北京高考真题化学试题变式题(有机综合题)(已下线)专题21 有机推断题(已下线)专题21 有机推断题北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市第五中学2023-2024学年高三上学期12月月考化学试题
4 . 回答了问题:
(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了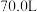 ,混合气体中丙烷和丁烷的体积比为
,混合气体中丙烷和丁烷的体积比为_______
(2)现有① ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ 六种有机物:①将等物质的量的上述有机物分别在足量的氧气中充分燃烧,消耗氧气的量相等的是
六种有机物:①将等物质的量的上述有机物分别在足量的氧气中充分燃烧,消耗氧气的量相等的是_______ (填序号,下同)②将等质量的上述有机物分别在足量的氧气中充分燃烧,消耗氧气的量相等的是_______
(3)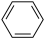 、
、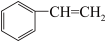 、
、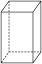 组成的混合物中碳的质量分数为
组成的混合物中碳的质量分数为__ (结果保留三位有效数字)
(4)在下列反应中,属于取代反应,加成反应 ,氧化反应的正确组合是__ 。
①由乙烯制一氯乙烷②乙烯使酸性高锰酸钾溶液褪色③乙烷在光照下与氯气反应;④ ⑤乙烯使溴水褪色
⑤乙烯使溴水褪色 由苯制取溴苯⑦SO3与水反应
由苯制取溴苯⑦SO3与水反应
A.③ ①④②⑦ B.③⑥ ①⑤ ② C.③⑥ ⑦ ①⑤
(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了
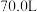 ,混合气体中丙烷和丁烷的体积比为
,混合气体中丙烷和丁烷的体积比为(2)现有①
 ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥ 六种有机物:①将等物质的量的上述有机物分别在足量的氧气中充分燃烧,消耗氧气的量相等的是
六种有机物:①将等物质的量的上述有机物分别在足量的氧气中充分燃烧,消耗氧气的量相等的是(3)
 、
、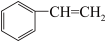 、
、 组成的混合物中碳的质量分数为
组成的混合物中碳的质量分数为(4)在下列反应中,属于取代反应,加成反应 ,氧化反应的正确组合是
①由乙烯制一氯乙烷②乙烯使酸性高锰酸钾溶液褪色③乙烷在光照下与氯气反应;④
 ⑤乙烯使溴水褪色
⑤乙烯使溴水褪色 由苯制取溴苯⑦SO3与水反应
由苯制取溴苯⑦SO3与水反应A.③ ①④②⑦ B.③⑥ ①⑤ ② C.③⑥ ⑦ ①⑤
您最近半年使用:0次
名校
解题方法
5 . 苯磺酸钠(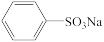 )是一种白色片状晶体,可用于有机合成、洗涤助剂和农药等,实验室模拟工业生产采用发烟硫酸磺化法制备,反应途径如下:
)是一种白色片状晶体,可用于有机合成、洗涤助剂和农药等,实验室模拟工业生产采用发烟硫酸磺化法制备,反应途径如下:
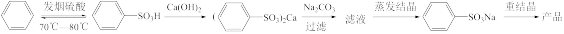
已知:①苯磺酸是一元强酸,苯磺酸、苯磺酸钠和苯磺酸钙都易溶于水,溶液均为无色;
②苯磺酸钠常温下微溶于乙醇,随着温度升高,溶解度显著增大;苯磺酸钙、Na2CO3可溶于乙醇,溶解度受温度影响较小。
操作步骤:
Ⅰ.苯的磺化反应。装置如图所示(加热装置省略),装入药品,通冷凝水,向烧瓶中缓慢加入b中试剂,稍冷后水浴加热充分反应,当c中无液体流下时,立即停止反应;
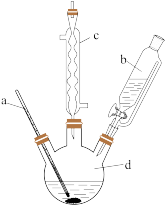
Ⅱ.将反应液转移到盛有适量澄清石灰水的烧杯中,用澄清石灰水调至中性;
Ⅲ.加入稍过量的Na2CO3溶液至不再产生沉淀为止,过滤,洗涤。将滤液蒸发结晶,得到苯磺酸钠粗品;
IV.重结晶法纯化苯磺酸钠。
回答下列问题:
(1)仪器b中盛装的试剂是_________ ,仪器c的名称是_________ 。
(2)由苯生成苯磺酸的化学方程式为_________ (发烟硫酸用浓H2SO4表示)。
(3)第Ⅲ步中滤渣成分是_________ (填化学式),该步洗涤的目的是_________ 。
(4)第Ⅳ步重结晶操作时,溶解粗品的装置应选择下图中的装置_________ (填字母代号),主要原因是_________ 。

(5)产品中杂质Ca2+含量的测定,已知:
①EDTA(简写为Y4-)能与Ca2+发生反应:Ca2++ Y4-(无色)=CaY2- (无色溶液);
②钙指示剂(简写为In2-)能与Ca2+发生反应:Ca2++In2-=CaIn (红色溶液);
③CaIn稳定性弱于CaY2-,pH为12~13时,可发生反应:CaIn+Y4-=CaY2-+In2- (蓝色溶液)。
现取10.00 g苯磺酸钠样品,配制为100 mL溶液,取其中20.00 mL于锥形瓶,将pH调至12~13(所加试剂不影响滴定),加入2~3滴钙指示剂,用0.01 mol/L的EDTA标准溶液进行滴定,当达到终点时,消耗16.00 mL标准溶液。则滴定终点时的现象是_________ ,苯磺酸钠样品中钙的质量分数为_________ %(保留2位小数)。
 )是一种白色片状晶体,可用于有机合成、洗涤助剂和农药等,实验室模拟工业生产采用发烟硫酸磺化法制备,反应途径如下:
)是一种白色片状晶体,可用于有机合成、洗涤助剂和农药等,实验室模拟工业生产采用发烟硫酸磺化法制备,反应途径如下: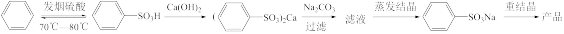
已知:①苯磺酸是一元强酸,苯磺酸、苯磺酸钠和苯磺酸钙都易溶于水,溶液均为无色;
②苯磺酸钠常温下微溶于乙醇,随着温度升高,溶解度显著增大;苯磺酸钙、Na2CO3可溶于乙醇,溶解度受温度影响较小。
操作步骤:
Ⅰ.苯的磺化反应。装置如图所示(加热装置省略),装入药品,通冷凝水,向烧瓶中缓慢加入b中试剂,稍冷后水浴加热充分反应,当c中无液体流下时,立即停止反应;

Ⅱ.将反应液转移到盛有适量澄清石灰水的烧杯中,用澄清石灰水调至中性;
Ⅲ.加入稍过量的Na2CO3溶液至不再产生沉淀为止,过滤,洗涤。将滤液蒸发结晶,得到苯磺酸钠粗品;
IV.重结晶法纯化苯磺酸钠。
回答下列问题:
(1)仪器b中盛装的试剂是
(2)由苯生成苯磺酸的化学方程式为
(3)第Ⅲ步中滤渣成分是
(4)第Ⅳ步重结晶操作时,溶解粗品的装置应选择下图中的装置

(5)产品中杂质Ca2+含量的测定,已知:
①EDTA(简写为Y4-)能与Ca2+发生反应:Ca2++ Y4-(无色)=CaY2- (无色溶液);
②钙指示剂(简写为In2-)能与Ca2+发生反应:Ca2++In2-=CaIn (红色溶液);
③CaIn稳定性弱于CaY2-,pH为12~13时,可发生反应:CaIn+Y4-=CaY2-+In2- (蓝色溶液)。
现取10.00 g苯磺酸钠样品,配制为100 mL溶液,取其中20.00 mL于锥形瓶,将pH调至12~13(所加试剂不影响滴定),加入2~3滴钙指示剂,用0.01 mol/L的EDTA标准溶液进行滴定,当达到终点时,消耗16.00 mL标准溶液。则滴定终点时的现象是
您最近半年使用:0次
2022-11-28更新
|
347次组卷
|
2卷引用:重庆2023届拔尖强基联合11月定时检测化学试题
6 . A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
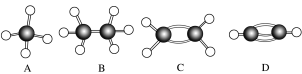

(1)常温下含氢质量分数最高的气态烃是_______ (填字母)。
(2)写出E失去一个氢原子后所得烃基的结构简式:_______ 。
(3)一卤代物种类最多的是_______ (填字母)。
(4)写出实验室用乙醇制取C的化学方程式:_______ ,反应类型_______ 。
(5)写出实验室制取D的化学方程式:_______ 。
(6)写出F发生硝化反应的化学方程式:_______ ,反应类型_______


(1)常温下含氢质量分数最高的气态烃是
(2)写出E失去一个氢原子后所得烃基的结构简式:
(3)一卤代物种类最多的是
(4)写出实验室用乙醇制取C的化学方程式:
(5)写出实验室制取D的化学方程式:
(6)写出F发生硝化反应的化学方程式:
您最近半年使用:0次
7 . 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图。加热聚丙烯废塑料得到的产物如下表:

(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物 电石
电石 乙炔
乙炔 聚乙炔
聚乙炔
写出反应②和反应③的化学方程式:_______ 、_______ 。
(2)乙装置试管中收集到的产品的成分为_______ ,最后收集到的气体产物为_______ 。
(3)写出一个丙装置中发生反应的方程式_______ 。属于______ 反应
(4)写出产物中苯与硝酸制备硝基苯的方程式_______ 。属于______ 反应。
(5)下列有关该实验各产物的叙述正确的是
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |

(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物
 电石
电石 乙炔
乙炔 聚乙炔
聚乙炔写出反应②和反应③的化学方程式:
(2)乙装置试管中收集到的产品的成分为
(3)写出一个丙装置中发生反应的方程式
(4)写出产物中苯与硝酸制备硝基苯的方程式
(5)下列有关该实验各产物的叙述正确的是
| A.甲烷的二氯代物(CH2Cl2)有2种 |
| B.装置乙试管中收集到的液体可以使溴水褪色 |
| C.装置丙中试剂吸收气体后所得产物密度均比水小 |
| D.最后收集的气体可以作为清洁燃料使用 |
您最近半年使用:0次
8 . 某实验小组用如图所示的装置制备硝基苯实验步骤如下:

I.配制浓硫酸与浓硝酸(体积比为4:3)的混合物(即混酸)35mL;
II.在三颈烧瓶中加入13g苯;
III.按图示装好药品并装好其他仪器;
IV.向三颈烧瓶里加入混酸,并不断搅拌(磁力搅拌器已略去);
V.控制温度在50-60℃,一段时间后三颈烧瓶内有淡黄色油状液体出现;
VI.分离出硝基苯经提纯最终得到纯净的硝基苯12.3g。
可能用到的有关数据如下:
①苯的密度: ,沸点:
,沸点: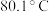 ;
;
②硝酸的密度: (质量分数为63%),沸点:
(质量分数为63%),沸点: 。
。
回答下列问题:
(1)仪器d的名称为_______ ,其作用是_______ 。
(2)配制一定比例的浓 和浓
和浓 的混合酸时,操作注意事项是
的混合酸时,操作注意事项是_______ 。
(3)三颈烧瓶内发生的主要反应的化学方程式为_______ 。
(4)硝基苯的密度比水的_______ (填“大”或“小”);纯净的硝基苯是油状无色液体,而实验所得的硝基苯是淡黄色油状液体,原因是_______ 。
(5)将粗产品依次用蒸馏水和5%的 溶液洗涤,最后再用蒸馏水洗涤。若用无水
溶液洗涤,最后再用蒸馏水洗涤。若用无水 干燥后将粗硝基苯进行蒸馏则可得到纯硝基苯。
干燥后将粗硝基苯进行蒸馏则可得到纯硝基苯。
①加入 溶液的作用是
溶液的作用是_______ 。
②本实验中硝基苯的产率是_______ 。

I.配制浓硫酸与浓硝酸(体积比为4:3)的混合物(即混酸)35mL;
II.在三颈烧瓶中加入13g苯;
III.按图示装好药品并装好其他仪器;
IV.向三颈烧瓶里加入混酸,并不断搅拌(磁力搅拌器已略去);
V.控制温度在50-60℃,一段时间后三颈烧瓶内有淡黄色油状液体出现;
VI.分离出硝基苯经提纯最终得到纯净的硝基苯12.3g。
可能用到的有关数据如下:
①苯的密度:
 ,沸点:
,沸点: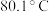 ;
;②硝酸的密度:
 (质量分数为63%),沸点:
(质量分数为63%),沸点: 。
。回答下列问题:
(1)仪器d的名称为
(2)配制一定比例的浓
 和浓
和浓 的混合酸时,操作注意事项是
的混合酸时,操作注意事项是(3)三颈烧瓶内发生的主要反应的化学方程式为
(4)硝基苯的密度比水的
(5)将粗产品依次用蒸馏水和5%的
 溶液洗涤,最后再用蒸馏水洗涤。若用无水
溶液洗涤,最后再用蒸馏水洗涤。若用无水 干燥后将粗硝基苯进行蒸馏则可得到纯硝基苯。
干燥后将粗硝基苯进行蒸馏则可得到纯硝基苯。①加入
 溶液的作用是
溶液的作用是②本实验中硝基苯的产率是
您最近半年使用:0次
20-21高三·全国·阶段练习
9 . 下列实验操作能达到预期实验目的的是
| 编号 | 实验操作 | 实验目的 |
| A | 将10g胆矾溶于90g水中 | 配制质量分数为10%的硫酸铜溶液 |
| B | 向盛有1mL0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至沉淀不再发生,再滴入0.1mol/LKI溶液 | 说明一种沉淀能转化为溶度积更小的另一种沉淀 |
| C | 室温,分别向2支试管中加入同体积同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的浓硫酸 | 研究温度对化学平衡的影响 |
| D | 甲苯中滴入少量浓溴水振荡,静置 | 研究甲苯能和溴发生取代反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 . 下列有关苯与乙烯的比较中,正确的是
| A.两者碳的百分含量都大于80% | B.都能被酸性高锰酸钾溶液氧化 |
| C.都能与溴水反应使溴水褪色 | D.等质量的苯和乙烯完全燃烧时,苯耗氧量大 |
您最近半年使用:0次



