21-22高二下·全国·单元测试
解题方法
1 . 同周期、同主族元素性质的递变规律
| 性质 | 同一周期(从左到右) | 同一主族(从上到下) | |
| 核外电子的排布 | 能层数 | ||
| 最外层电子数 | 1→2或8 | ||
| 金属性 | |||
| 非金属性 | |||
| 单质的氧化性、还原性 | 氧化性 | ||
| 还原性 | |||
| 最高价氧化物对应水化物的酸碱性 | 酸性 | ||
| 碱性 | |||
| 气态氢化物的稳定性 | |||
| 第一电离能 | |||
| 电负性 | |||
您最近一年使用:0次
13-14高三·上海·阶段练习
2 . 某电镀铜厂有两种废水,分别含有CN-和Cr2O72-等有毒离子,拟用NaClO和Na2S2O3按照下列流程进行处理。

完成下列填空:
(1)HCN有剧毒,电子式是___ ,其分子属于___ (填“极性”、“非极性”)分子。
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:___ ,氮原子核外有___ 种能量不同的电子。
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是___ 。
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:___ 。
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为___ 个。
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因___ 。

完成下列填空:
(1)HCN有剧毒,电子式是
(2)选用最详尽描述核外电子运动状态的方式,来表示氮原子的最外层电子:
(3)下列事实能说明氯与硫两元素非金属性相对强弱的是
a.相同条件下水溶液的酸性:HClO3>H2SO3
b.稳定性:HCl>H2S
c.相同条件下水溶液的pH:Na2S>NaCl
d.还原性:S2->Cl-
(4)写出流程②的离子方程式:
(5)反应②中,每消耗1.5mol Cr2O72-转移电子的数目为
(6)取少量待检水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀,用平衡移动原理解释产生该现象的原因
您最近一年使用:0次
3 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______ ;_______________ ;
(3)Se原子序数为_______ ,其核外M层电子的排布式为___________________ ;
(4)H2Se的酸性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为______________ ,SO32-离子的立体构型为___________________ ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:_____________________________________ ;
② H2SeO4比 H2SeO3酸性强的原因:______________________________________________________________
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是
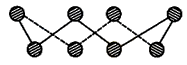
(3)Se原子序数为
(4)H2Se的酸性比H2S
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
② H2SeO4比 H2SeO3酸性强的原因:
您最近一年使用:0次
2016-12-09更新
|
587次组卷
|
3卷引用:苏教版高二化学选修三单元测试题:2.2 元素性质的递变规律



