名校
1 . 我国拥有自主知识产权的硅衬底高光效氮化镓发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域。镓元素的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法正确的是
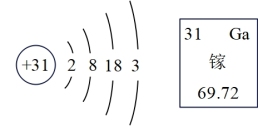

| A.镓元素位于元素周期表的第四周期 |
| B.一个Ga原子有28个电子 |
| C.镓的相对原子质量为69.72 g |
| D.镓元素为非金属元素 |
您最近一年使用:0次
2022-05-07更新
|
914次组卷
|
6卷引用:第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)陕西省榆林市第一中学2021-2022学年高一下学期期中考试化学试题(已下线)第18讲 原子结构-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第16讲 原子结构和元素周期表-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)【定心卷】4.1.2 元素周期表随堂练习-人教版2023-2024学年必修第一册
解题方法
2 . 有四种元素原子的基态或激发态原子的电子排布式如下:
①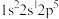 ②
②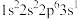 ③
③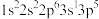 ④
④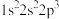
下列说法错误的是
①
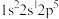 ②
②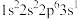 ③
③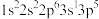 ④
④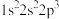
下列说法错误的是
| A.元素①的一种单质可用于消毒杀菌 | B.元素②所在周期中其原子半径最大 |
| C.元素①③在周期表中位于第17列 | D.元素④的简单氢化物常作制冷剂 |
您最近一年使用:0次
2022-05-05更新
|
560次组卷
|
3卷引用:第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
名校
3 . 2016年IUPAC命名117号元素为Ts,其最外层电子数为7,下列说法不正确 的是
| A.Ts是第七周期第ⅦA族元素 | B.Ts的最高化合价为+7价 |
| C.Ts的同位素原子具有相同的质子数 | D.Ts在同族元素中非金属性最强 |
您最近一年使用:0次
2022-04-03更新
|
587次组卷
|
4卷引用:【知识图鉴】单元讲练测必修第一册第四单元02基础练
(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练北京市汇文中学2021-2022学年高一上学期期末考试化学试卷(已下线)4.1.4 原子结构与元素的性质-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题
4 . 元素R的+2价离子的电子排布式为1s22s22p63s23p63d6,下列说法正确的是
| A.R2+比R3+稳定性强 |
| B.R位于周期表的第三周期第ⅤB族,属于ds区 |
| C.R位于周期表的第四周期第Ⅷ族,属于d区 |
| D.R元素名称为铬 |
您最近一年使用:0次
2022-04-01更新
|
576次组卷
|
2卷引用:第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
5 . 元素周期表中前四周期几种主族元素的位置关系如图所示(过渡元素已忽略)。
请回答下列问题。
(1)①和②能形成简单化合物,该物质的化学式为_______ ,已知该物质为离子化合物,两种离子半径①_______ ②(填“>”“<”或“=”)。
(2)④、⑤、⑥三种元素的第一电离能由大到小的顺序为_______ (用元素符号表示,下同),电负性由大到小的顺序为_______ 。
(3)③、⑨、⑪分别与①形成简单二元化合物,三种物质的热稳定性从强到弱的顺序为_______ (用化学式表示)。
(4)元素⑦的基态原子的电子排布式为_______ ,其电子占据的最高能级的轨道形状为_______ 。
(5)元素⑩的焰色为紫色,从微观角度解释元素产生焰色反应的原因_______ 。
| ① | |||||||||||||||||
| ② | ③ | ||||||||||||||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||
| ⑩ | ⑾ |
(1)①和②能形成简单化合物,该物质的化学式为
(2)④、⑤、⑥三种元素的第一电离能由大到小的顺序为
(3)③、⑨、⑪分别与①形成简单二元化合物,三种物质的热稳定性从强到弱的顺序为
(4)元素⑦的基态原子的电子排布式为
(5)元素⑩的焰色为紫色,从微观角度解释元素产生焰色反应的原因
您最近一年使用:0次
13-14高二下·宁夏银川·期末
6 . 下列说法或有关化学用语的表达正确的是
| A.在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B.基态Fe原子的外围电子排布图为: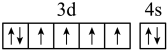 |
| C.因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D.根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
您最近一年使用:0次
2024-02-04更新
|
231次组卷
|
62卷引用:2017-2018学年人教版高中化学选修三 模块综合质量检测
2017-2018学年人教版高中化学选修三 模块综合质量检测(已下线)模块同步卷12 综合检测卷(提升卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(已下线)2013-2014宁夏银川一中高二下学期期末考试化学试卷2014-2015学年宁夏宁大附中高二上学期期中考试化学试卷2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2015-2016学年山西省大同一中高二下3月月考化学试卷2015-2016学年贵州省思南中学高二下期中化学试卷2015-2016学年辽宁省五校协作体高二下学期期中考试化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷山西省大同市第一中学2016-2017学年高二5月月考化学试题新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题贵州省思南中学2016-2017学年高二下学期期末考试化学试题吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题四川省广安市第二中学校2017-2018学年高二下学期第二次月考化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题吉林省扶余市第一中学2018-2019学年高二下学期第一次月考化学试题内蒙古自治区第一机械制造(集团)有限公司第一中学2018-2019学年高二下学期期中考试化学试题山东省聊城市2019-2020学年高三化学一轮复习《物质结构与性质(》模拟测试四川省广安第二中学校2017-2018学年高二下学期第一次月考化学试题辽宁省丹东市2017-2018学年高二下学期期末质量监测化学试题广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题陕西省榆林市第十二中学2019-2020学年高二下学期期中考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期期中考试化学试题江苏省如东高级中学2019-2020学年高一下学期第二次阶段测试化学试题安徽省安庆市太湖县2019-2020学年高二下学期期中质量调研考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题四川省南充市阆中中学2020-2021学年高二上学期期中考试化学试题安徽省蚌埠第三中学2019-2020学年高二下学期期末考试化学试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记山东省济南市济阳区闻韶中学2020-2021学年高三(3班)12月第一次模拟考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题辽宁省沈阳市辽中区第一高级中学2020-2021学年高二下学期开学考试化学试题天津市实验中学滨海学校2020-2021学年高二下学期期中化学试题甘肃省武威第十八中学2020-2021学年高二下学期期中考试化学试题(已下线)作业02 原子结构与元素的性质-2021年高二化学暑假作业(人教版2019)新疆昌吉教育共同体2020-2021学年高二下学期期末质量检测化学试题福建省漳州市正兴学校2020-2021学年高二下学期期末考试化学试题宁夏银川市第六中学2020-2021学年高二下学期期末考试化学试题四川省遂宁市第二中学校2021-2022学年高二上学期期中考试化学试题辽宁省本溪市第二高级中学2021-2022学年高二上学期期末考试化学试题山西省长治市沁源县第一中学等名校2021-2022学年高二下学期5月联考化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第一章 本章复习提升1云南省石屏县第一中学2021-2022学年高二下学期3月份考试化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高二下学期期中考试化学试题四川省广安市邻水县二中 2022-2023学年高三上学期9月考化学试题甘肃省庆阳市第六中学2021-2022学年高二下学期期末考试化学试题福建省泉州科技中学2021-2022学年高二下学期期中考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题山东省新泰市第一中学2022-2023学年高二下学期第一次大单元考试化学试题山东省青岛第十九中学2022-2023学年高二下学期4月月考化学试题宁夏青铜峡市宁朔中学2022-2023学年高二下学期期中考试化学试题四川省广元中学2022-2023学年高二下学期5月期中考试化学试题安徽省安庆市第二中学2022-2023学年高二下学期期中考试化学试题河北省唐山市开滦一中2022-2023学年高二下学期期末考试化学试题吉林省普通高中友好学校联合体2023-2024学年高二上学期第三十七届基础年段期末联考化学试题湖南省长郡中学2023-2024学年高二下学期寒假检测(开学考试)化学试题湖北省武汉西藏中学2023-2024学年高二下学期4月月考化学试题(已下线)猜想01 原子结构与性质 【考题猜想】(8大题型)-2023-2024学年高二化学下学期期末考点大串讲(人教版2019)
名校
7 . 下列数字代表各元素的原子序数,则各组中相应的元素能形成 型共价化合物的是
型共价化合物的是
 型共价化合物的是
型共价化合物的是| A.11和9 | B.1和16 | C.12和17 | D.6和16 |
您最近一年使用:0次
2022-03-01更新
|
808次组卷
|
5卷引用:第四章 物质结构 元素周期律(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
(已下线)第四章 物质结构 元素周期律(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)河南省林州市2021-2022学年高一上学期期末考试化学试题上海市实验学校2021-2022学年高一下学期线上教学阶段检测化学试题(已下线)4.3.2 共价键-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)考点巩固卷05 物质结构 元素周期律(2大考点50题)-2024年高考化学一轮复习考点通关卷(新高考通用)
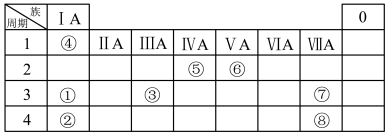
8 . 几种主族元素在周期表中的位置如下
(1)⑥元素的简单氢化物的化学式是_______ 。
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_______ ,该元素在周期表中的位置是_______ 。
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式)①与③最高价氧化物对应水化物反应的离子方程_______ 。
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:_______ 。下列表述中能证明这一事实的是_______ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
(1)⑥元素的简单氢化物的化学式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,从原子结构的角度解释其原因:
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
您最近一年使用:0次
2022-01-22更新
|
941次组卷
|
4卷引用:【知识图鉴】单元讲练测必修第一册第四单元02基础练
(已下线)【知识图鉴】单元讲练测必修第一册第四单元02基础练广东省湛江市2021-2022学年高一上学期期末调研考试化学试题(已下线)专题突破卷05?物质结构 元素周期律?-2024年高考化学一轮复习考点通关卷(新教材新高考)天津市武清区黄花店中学2023-2024学年高三上学期第二次练习化学试题
9 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
785次组卷
|
4卷引用:第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖南省怀化市2021-2022学年高一上学期期末考试化学试题湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】
2020·浙江·模拟预测
10 . 下列说法正确的是
| A.同一原子中,在离核较远的区域运动的电子能量较高 |
| B.原子核外电子排布,先排满K层再排L层、先排满M层再排N层 |
| C.同一周期中,随着核电荷数的增加,元素的原子半径逐渐增大 |
| D.同一周期中,ⅡA与ⅢA族元素原子的核电荷数都相差1 |
您最近一年使用:0次
2022-09-30更新
|
1502次组卷
|
46卷引用:鲁科版(新)必修第二册第一章检测题
鲁科版(新)必修第二册第一章检测题(已下线)浙江省2020年1月选考(学考)化学试题2020年浙江省高考化学试卷(1月选考)浙江省丽水市松阳县第二中学2019-2020学年高二4月线上教学检测化学试题天津市河东区2020届高三学业水平等级性考试模拟测试化学试题河南省洛阳市2019-2020学年高一下学期期末考试化学试题(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷(已下线)【浙江新东方】50.广东省深圳外国语学校2021届高三第二次月考化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 C高考挑战区(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练山东省泰安肥城市2020-2021学年高一下学期期中考试化学试题河北省/唐山市第十一中学2020-2021学年高一下学期期中考试化学试题(已下线)课时26 元素周期表(律)及其应用-2022年高考化学一轮复习小题多维练(全国通用)四川省内江市2020-2021学年高一下学期期末检测题化学(理)试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)四川省资阳中学2021-2022学年高二上学期开学考试化学试题四川省遂宁市射洪中学2021—2022学年高二上学期第一次月考化学试题(已下线)专题07.物质结构 元素周期律-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(实验班)化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)第1.2.1讲 原子结构与元素周期表-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)山西省晋城市第一中学2021-2022学年高二上学期第五次调研化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)4.2.1 元素性质的周期性变化规律-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第09练 原子结构与元素周期表-2023年高考化学一轮复习小题多维练(全国通用)广东省汕头市金山中学2021-2022学年高二上学期期末考试化学试题(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)江苏省苏州市2021-2022学年高二上学期期末模块测评化学试题四川省南充市嘉陵第一中学2021-2022学年高二上学期第二次月考化学试题广东省广州市执信中学2022-2023学年高三上学期第二次月考 化学试题(已下线)第36讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题八 物质结构与元素周期律-实战高考·二轮复习核心突破湖北省襄阳市第一中学2022-2023学年高二下学期3月月考化学试题四川省广安市第二中学校2022-2023学年高二下学期第一次月考化学试题安徽省合肥市第一中学 2022-2023 学年高一下学期第一次素质拓展训练化学试题浙江省杭州市周边四校2022-2023学年高二上学期期末联考化学试题广东省广州市白云中学2023-2024学年高三上学期9月月考化学试题浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题2024年江苏省常州市普通高中学业水平合格性考试适应性训练化学试题甘肃省酒泉市实验中学2023-2024学年高二下学期3月月考化学试卷



