2019高三下·全国·专题练习
名校
1 . X、Y、Z、W四种元素为短周期元素,它们在元素周期表中的相对位置如图所示,已知W的最高正价与最低负价代数和为6,下列说法正确的是( )
| X | Y | |
| Z | W |
| A.Z的简单氢化物沸点高于Y的简单氢化物沸点 |
| B.标准状况下,X的单质状态与W的相同 |
| C.X、Z、W最高价氧化物对应的水化物均为强酸,且X对应的酸性最强 |
| D.Z的简单离子还原性弱于W的简单离子还原性 |
您最近一年使用:0次
2019-03-27更新
|
729次组卷
|
5卷引用:人教版高中化学选修3第一章《原子结构与性质》测试题
人教版高中化学选修3第一章《原子结构与性质》测试题(已下线)2019年3月2019届高三第一次全国大联考(新课标Ⅲ卷)-化学新疆维吾尔自治区兵团第二师华山中学2018-2019学年高一下学期第一次调研化学试题四川省内江市第三中学2021-2022学年高一下学期期中考试化学试题四川省泸县第一中学2021-2022学年高一下学期第一次月考试化学试题
2 . 四种短周期主族元素在元素周期表中的相对位置如图所示,X元素的原子核外电子数是M的2倍,Y的氧化物具有两性。回答下列问题:
(1)元素Y在周期表中的位置是第________ 周期________ 族。
(2)这四种元素最高价氧化物对应的水化物中,酸性最强的是_________ (填化学式,下同),碱性最强的是________ 。
(3)气体分子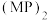 的电子式为
的电子式为_________ 。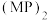 称为拟卤素,性质与卤素类似,其与NaOH溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与NaOH溶液反应的化学方程式为__________ 。
M | P | ||
X | Y |
(1)元素Y在周期表中的位置是第
(2)这四种元素最高价氧化物对应的水化物中,酸性最强的是
(3)气体分子
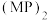 的电子式为
的电子式为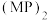 称为拟卤素,性质与卤素类似,其与NaOH溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与NaOH溶液反应的化学方程式为
您最近一年使用:0次
名校
3 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
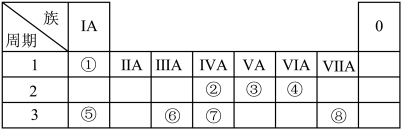
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________ 。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________ 。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________ 。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________ 。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
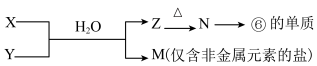
X溶液与Y溶液反应的离子方程式为___________________________________

(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)
(2)⑤、⑧元素的化合物的用电子式表示形成过程:
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
您最近一年使用:0次
2019-08-13更新
|
329次组卷
|
4卷引用:第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
(已下线)第四章《物质结构 元素周期律》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)新疆奎屯市第一高级中学2018-2019学年高一下学期第一次月考化学试题(已下线)专题10 化学键(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学(已下线)【南昌新东方】莲塘一中 2019-2020 学年高一年级 4 月网络考试化学
名校
解题方法
4 . 如图是元素周期表的一部分,请回答下列问题:
(1)在这些元素中,单质的化学性质最不活泼 的是___ (填元素符号)。
(2)③的气态氢化物的电子式___ ,②④形成的气态化合物的结构式___ 。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___ (填物质的化学式),写出它的电子式:___ ;酸性最强的含氧酸为___ (填物质的化学式),写出它的电离方程式:___ 。
(4)在②和③两种元素中,非金属性较强的是___ (填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___ 。
(5)②与Si元素分别形成的最高价氧化物,___ 的熔点更高,原因是___ 。
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质
(2)③的气态氢化物的电子式
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为
(4)在②和③两种元素中,非金属性较强的是
(5)②与Si元素分别形成的最高价氧化物,
您最近一年使用:0次
2020-04-24更新
|
268次组卷
|
2卷引用:鲁科版(新)必修第二册第一章检测题
名校
解题方法
5 . 根据下表回答下列问题。
(1)写出下列元素符号:①______ ,⑥______ ,⑦______ ,⑨______ 。
(2)在这些元素中,最活泼的金属元素是______ (填元素符号,下同),最活泼的非金属元素是______ ,最不活泼的元素是______ 。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________________ ,碱性最强的是__________________ ,呈两性的氢氧化物是__________________ ;三者之间相互反应的化学方程式是____________________________________ 。
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是__________ ,原子半径最大的是____ 。
(5)在③与④中,化学性质较活泼的是__________ ,怎样用化学实验证明?______________ 在⑧与⑫中,化学性质较活泼的是______ ,怎样用化学实验证明?________________________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是
(4)在这些元素(稀有气体元素除外)中,原子半径最小的是
(5)在③与④中,化学性质较活泼的是
您最近一年使用:0次
2020-03-02更新
|
118次组卷
|
3卷引用:第1章原子结构与元素周期律 易错疑难集训(二)
名校
6 . 实验题
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
②【评价】甲同学设计的实验方案的合理性是___________ (填序号)
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________ 。
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
请回答下列问题:
①写出Z的原子结构示意图:__________________ 。
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可)_____
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:__________________ 。
甲同学拟通过实验探究同主族元素性质的递变规律。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂: NaBr溶液、NaI溶液、新制的氯水
(1)实验目的:
①写出下列实验报告中的实验现象和离子方程式
| 实验步骤 | 实验现象 | 实验结论及离子方程式 |
 | 甲 乙 | 离子方程式 甲 乙 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
②【评价】甲同学设计的实验方案的合理性是
A. 非常合理 B. 部分合理 C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是
(2)下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧。
| W | X | Y |
| Z |
请回答下列问题:
①写出Z的原子结构示意图:
②探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中用Z表示即可)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI===Z↓+2I2+3H2O |
| 1 | ||
| 2 |
③由C、O和Y三种元素组成的化合物COY中,所有原子的最外层都满足8电子结构。写出该化合物的电子式:
您最近一年使用:0次
2018-04-17更新
|
387次组卷
|
3卷引用:第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)第04章 物质结构 元素周期律(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)天津市静海县第一中学2017-2018学年高一4月学生学业能力调研测试化学试题福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题



