1 . 针对表中10种元素及由这些元素形成的单质和化合物,用元素符号或者化学式填写以下空格。
(1)最活泼的金属元素是___________ ,最活泼的非金属元素是___________ ,最不活泼的元素是___________ 。
(2)碱性最强的最高价氧化物对应水化物是___________ ,酸性最强的最高价氧化物对应水化物是___________ ,最稳定的气态氢化物是___________ 。
(3)在④与⑤中,还原性较强的是___________ ,在⑧与⑨的单质中,氧化性较强的是___________ 。
(4)④的最高价氧化物对应的水化物和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:___________ ;用电子式表示④和⑧形成的化合物的形成过程___________ 。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)碱性最强的最高价氧化物对应水化物是
(3)在④与⑤中,还原性较强的是
(4)④的最高价氧化物对应的水化物和⑥的最高价氧化物对应的水化物相互反应的化学方程式为:
您最近一年使用:0次
名校
2 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
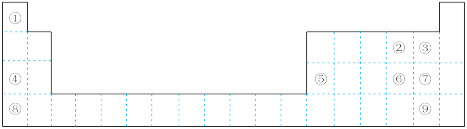
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为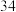
B.气态氢化物的稳定性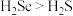
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
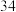
B.气态氢化物的稳定性
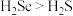
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
3 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,丰富舌尖上的营养和美味。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为___________ 。工业上用浓H2SO4焙烧CuSe的方法提取硒(其中Cu转化为CuSO4),且有SO2、H2O和SeO2(固体)生成,写出发生反应的化学方程式:___________ 。理论上该反应每转移1mol电子,得到的SeO2的质量为___________ 。
(2)下列说法正确的是___________。
(3)短周期元素d.e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
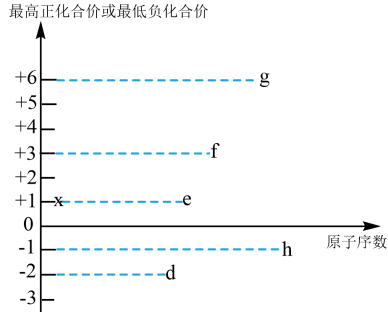
①由x、h、d三种元素组成的化合物的电子式为___________ 。
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程___________ 。
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为___________ mol。若忽略反应前后溶液体积变化,则最终所得溶液中溶质的物质的量浓度为___________ mol•L-1.若要将溶液中的铁元素全部转化为Fe3+,至少需要标准状况下Cl2的体积为___________ L。
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为
(2)下列说法正确的是___________。
A.热稳定性: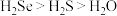 | B.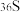 与 与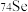 的中子数之和为60 的中子数之和为60 |
C.酸性: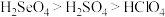 | D.还原性:Se2- < S2- |

①由x、h、d三种元素组成的化合物的电子式为
②D.e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程
(4)向一定量的Fe和Fe2O3的混合物中加入480mL0.250mol•L-1稀盐酸后恰好完全溶解,放出标准状况下的气体672mL,在溶液中加入KSCN溶液无血红色出现。回答下列问题:产生的气体的物质的量为
您最近一年使用:0次
2024-01-05更新
|
536次组卷
|
2卷引用:山西运城盐湖五中2023-2024学年高一上学期化学期末练兵卷(三)
4 . 下列性质的比较,不能用元素周期律解释的是
A.热稳定性: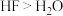 | B.氧化性: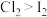 |
C.碱性: | D.酸性: |
您最近一年使用:0次
2024-01-28更新
|
161次组卷
|
2卷引用:河北省保定市2023-2024学年高一上学期1月期末化学试题
5 . 已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应的水化物酸性依次增强,则下列判断正确的是
| A.原子半径按X、Y、Z依次增大 |
| B.阴离子的还原性按X、Y、Z顺序增强 |
| C.单质的氧化性按X、Y、Z顺序增强 |
| D.氢化物的稳定性按Z、Y、X顺序增强 |
您最近一年使用:0次
名校
6 . 位于同一短周期的X、Y、Z三种元素,它们的最高价氧化物的水化物依次是HZO4、H2YO4、H3XO4,下列判断正确的是
| A.三种元素简单阴离子的还原性按X、Y、Z的顺序依次增强 |
| B.单质的氧化性按X、Y、Z的顺序依次减弱 |
| C.气态氢化物的稳定性按X、Y、Z的顺序依次增强 |
| D.酸性强弱顺序为H3XO4>H2YO4>HZO4 |
您最近一年使用:0次
名校
7 . X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
(1)写出元素X的原子结构示意图_____ ;元素W在周期表中位置_____ 。
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较_____ >_____ (填化学式)。
(3)用电子式表示X和R形成化合物的过程:_____ 。
(4)下列对于W及其化合物的推断中,正确的是_____ (填序号)。
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:

①A中发生的反应的离子方程式是_____ 。
②棉花中浸有的NaOH溶液的作用是_____ (用离子方程式表示)。
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到_____ 。该实验必须控制加入的R单质的量,否则得不出Br2的氧化性比I2强。理由是______ 。
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:______ 。
| 元素 | 元素性质或原子结构信息 |
| X | 短周期元素原子半径最大(稀有气体元素不参与比较) |
| Y | +3价阳离子的核外电子排布与氖原子相同 |
| Z | 原子核外M电子层与K电子层的电子数相等 |
| R | 与Z同周期,主要化合价为−1、+7 |
| W | 原子结构示意图: |
(1)写出元素X的原子结构示意图
(2)Y、Z最高价氧化物对应水化物的碱性强弱比较
(3)用电子式表示X和R形成化合物的过程:
(4)下列对于W及其化合物的推断中,正确的是
①W的最低负化合价与R的最低负化合价相同
②W的氢化物的稳定性弱于R的氢化物的稳定性
③W的单质可与X和R形成的化合物的水溶液发生置换反应
④W的最高价氧化物对应水化物的酸性比R的强
(5)为验证卤族部分元素单质氧化性的递变规律,设计如图装置进行实验,请回答:

①A中发生的反应的离子方程式是
②棉花中浸有的NaOH溶液的作用是
③为验证Br2与I2的氧化性强弱:通入一定量R的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到
④从原子结构的角度解释卤族元素单质氧化性逐渐减弱的原因:
您最近一年使用:0次
名校
8 . 下表是元素周期表的一部分。
(1)写出表中部分元素的元素符号:②___________ 、⑦___________ 。
(2)⑧的简单离子的结构示意图为___________ 。
(3)①~⑧元素形成的单质中氧化性最强的是___________ (填化学式,下同),还原性最强的是___________ 。
(4)②、③、⑦三种元素最高价氧化物对应的水化物中酸性最强的是___________ (填化学式,下同),②、③、④三种元素形成的简单氢化物中最稳定的是___________ 。
(5)将④、⑤、⑥三种元素的简单离子半径按由大到小的顺序排列:___________ (用离子符号表示)。
(6)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式为___________________ 。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VIIA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)⑧的简单离子的结构示意图为
(3)①~⑧元素形成的单质中氧化性最强的是
(4)②、③、⑦三种元素最高价氧化物对应的水化物中酸性最强的是
(5)将④、⑤、⑥三种元素的简单离子半径按由大到小的顺序排列:
(6)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
2022-01-26更新
|
284次组卷
|
2卷引用:安徽省合肥市部分学校2021-2022学年高一上学期期末考试化学试题
名校
9 . 硒( )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
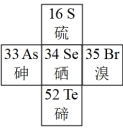
(1)硒在元素周期表中的位置如图所示:
① 在元素周期表中位置表示为
在元素周期表中位置表示为_______ ;
②用电子式表示 的形成过程:
的形成过程:_______ 。
(2)阳极泥中的硒主要以 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
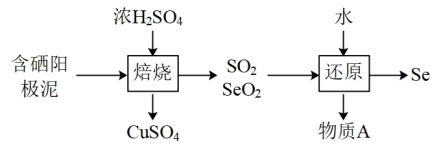
①请写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:_______ 。
②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:_______ 。
(3)下列说法正确的是_______。
 )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
(1)硒在元素周期表中的位置如图所示:
①
 在元素周期表中位置表示为
在元素周期表中位置表示为②用电子式表示
 的形成过程:
的形成过程:(2)阳极泥中的硒主要以
 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
①请写出
 与浓
与浓 反应的化学方程式:
反应的化学方程式:②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:
(3)下列说法正确的是_______。
A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.原子半径由大到小顺序: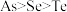 |
C.热稳定性: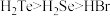 | D.酸性: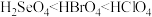 |
您最近一年使用:0次
2022-03-30更新
|
429次组卷
|
3卷引用:江苏省泰州中学2021-2022学年高一上学期期末考试化学试题
江苏省泰州中学2021-2022学年高一上学期期末考试化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题
解题方法
10 . 下列各组物质的性质由强到弱的顺序排列正确的是
| A.酸性:HClO4>H3PO4>H2SO4 | B.氢化物稳定性:HF>H2O>NH3 |
| C.碱性:Al(OH)3>Mg(OH)2>NaOH | D.氧化性:HI>HBr>HCl>HF |
您最近一年使用:0次



