名校
解题方法
1 . 元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R分别代表一种元素。请依据这7种元素回答下列问题:

(1)以上7种元素中原子半径最大的元素是___________ 。(填元素符号)
(2)Q的原子结构示意图为___________ 。
(3)A和F能组成原子个数比为1:1的化合物,该化合物的电子式为___________ ;D和F能组成原子个数比为1:2的化合物,该化合物的结构式为___________ 。
(4)A、G、F三种元素组成的化合物中有哪些化学键___________ 。
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验

请回答:
①仪器A的名称是___________ 。
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂___________ ,C中的实验现象___________ 。
(6)F、M的简单氢化物的沸点由高到低的顺序为___________ (用化学式表示),原因是___________ 。

(1)以上7种元素中原子半径最大的元素是
(2)Q的原子结构示意图为
(3)A和F能组成原子个数比为1:1的化合物,该化合物的电子式为
(4)A、G、F三种元素组成的化合物中有哪些化学键
(5)为了验证D和M二种元素非金属性的强弱,设计下图装置进行实验

请回答:
①仪器A的名称是
②现有试剂:稀硫酸、碳酸钠溶液、碳酸钙、硫酸钠溶液、澄清石灰水。从所给试剂中选择合适的试剂,用如图装置证明D和M两种元素非金属性:M>D,A中装试剂
(6)F、M的简单氢化物的沸点由高到低的顺序为
您最近一年使用:0次
解题方法
2 . A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
(1) 的电子式为
的电子式为__________ ;离子半径D__________ B(填“>”或“<”)。
(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为__________ ,该反应可用于制备漂白液。
②试管b中的实验现象为__________ ,说明X的非金属性强于碘元素,从原子结构的角度解释其原因是__________ 。
(3)镓 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是__________ (填字母序号)。
a. 位于元素周期表的第四周期
位于元素周期表的第四周期
b. 中
中 的化合价为
的化合价为
c. 的离子半径小于
的离子半径小于 的离子半径
的离子半径
(4)工业上用 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为__________ 。
 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空) (1)
 的电子式为
的电子式为(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为
②试管b中的实验现象为
(3)镓
 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是a.
 位于元素周期表的第四周期
位于元素周期表的第四周期b.
 中
中 的化合价为
的化合价为
c.
 的离子半径小于
的离子半径小于 的离子半径
的离子半径(4)工业上用
 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
3 . 已知X、Y、Z、M、G、Q是六种短周期主族元素,原子序数依次增大。X、Z、Q的单质在常温下均呈气态;Y的原子最外层电子数是其电子层数的2倍;M与X同族;Z、G分别是地壳中含量最高的非金属元素和金属元素。回答下列问题:
(1)M2Z的电子式为_______ 。
(2)上述元素的最高价氧化物对应的水化物中,碱性最强的是_______ (填化学式)。
(3)Y、Z、M、G四种元素的原子半径由大到小的顺序为_______ (用元素符号表示)。
(4)如图所示,将Q单质的水溶液分别滴入盛有不同试剂的试管中:

①试管a中发生反应的化学方程式为_____ ,该反应可用于制备漂白液。
②试管b中的现象为________ ,说明非金属性:Q_____ (填“>”、“<”或“=”)I。
(5)镓(Ga)与G同主族且相邻,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列说法正确的是____ (填字母)。
a.元素Ga位于周期表的第4周期IIIA族
b.一定条件下,Ga既能溶于稀盐酸又能溶于氢氧化钠溶液
c.离子半径:
d.常温下,Ga可与水剧烈反应放出氢气
(1)M2Z的电子式为
(2)上述元素的最高价氧化物对应的水化物中,碱性最强的是
(3)Y、Z、M、G四种元素的原子半径由大到小的顺序为
(4)如图所示,将Q单质的水溶液分别滴入盛有不同试剂的试管中:

①试管a中发生反应的化学方程式为
②试管b中的现象为
(5)镓(Ga)与G同主族且相邻,氮化镓(GaN)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,GaN商用进入快车道。下列说法正确的是
a.元素Ga位于周期表的第4周期IIIA族
b.一定条件下,Ga既能溶于稀盐酸又能溶于氢氧化钠溶液
c.离子半径:

d.常温下,Ga可与水剧烈反应放出氢气
您最近一年使用:0次
2021-07-08更新
|
144次组卷
|
3卷引用:陕西省蒲城县2021-2022学年高三上学期第一次对抗赛(期中考试)化学试题
名校
4 . A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________ 。
(2)用电子式表示E2F的形成过程___________ 。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________ 。
(4)下列实验操作对应的实验现象中,不正确的是________ (填字母)。
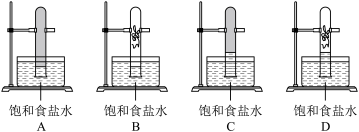
(5)写出A与B形成的10电子分子的化学式___________ ,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________ (填字母)。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是
(2)用电子式表示E2F的形成过程
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是
(4)下列实验操作对应的实验现象中,不正确的是
| 选项 | 实验操作 | 实验现象 |
| a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
| b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
| c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 下层溶液变为橙色 |
| d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |

您最近一年使用:0次
名校
解题方法
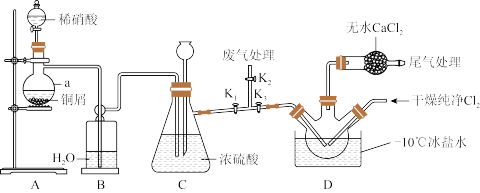
5 . 亚硝酰氯NOCl常用于合成洗涤剂、触媒及用作中间体,其熔点为-64.5℃,沸点-5.5℃,遇水易水解为两种酸。某学习小组在实验室用 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
(1)实验室用 制取
制取 的离子方程式为
的离子方程式为_______ 。
(2)装置A中仪器a的名称为_______ ,装置C中长颈漏斗的作用是_______ 。
(3)若不用装置D中的干燥管,对实验有何影响_______ (用化学方程式表示)。
(4)N、O、Cl的简单离子中半径最小的是_______ (填离子符号),简单氢化物的熔沸点由高到低的顺序是_______ (用化学式表示)。
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用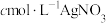 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为_______ 。
 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
(1)实验室用
 制取
制取 的离子方程式为
的离子方程式为(2)装置A中仪器a的名称为
(3)若不用装置D中的干燥管,对实验有何影响
(4)N、O、Cl的简单离子中半径最小的是
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用
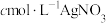 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
您最近一年使用:0次
2022-05-29更新
|
305次组卷
|
3卷引用:新疆生产建设兵团第六师五家渠高级中学2022-2023学年高三2月月考化学试题
6 . 已知:PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;2PCl3+O2=2POCl3。某化学学习小组用装置甲合成PCl3,并用装置乙采取PCl3氧化法制备POCl3
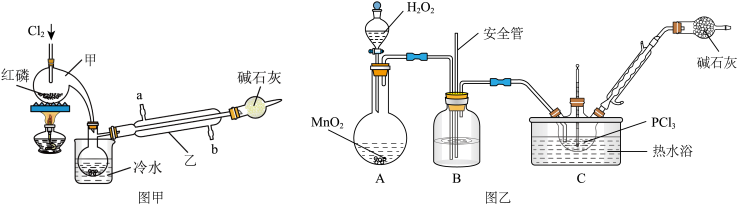
(1)氯元素在周期表中的位置是_____________
(2)H3PO3中所含元素原子半径由小到大的顺序为_____________
(3)能比较出氯的非金属性比磷的非金属性强的是______________
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止_____________ 进入烧瓶,影响产品纯度的作用
(5)图乙A装置中化学反应方程式是_____________
(6)POCl3水解的化学反应方程式为______________
(7)C中反应温度控制在60~65℃,其原因是____________________________________________________

(1)氯元素在周期表中的位置是
(2)H3PO3中所含元素原子半径由小到大的顺序为
(3)能比较出氯的非金属性比磷的非金属性强的是
A.HCl酸性比H3PO4的强 B.HCl稳定性比PH3的强
C.HClO4的酸性比H3PO3的强 D.PCl3中P显正三价,C1显负一价
(4)图甲碱石灰的作用除了处理尾气外还有防止
(5)图乙A装置中化学反应方程式是
(6)POCl3水解的化学反应方程式为
(7)C中反应温度控制在60~65℃,其原因是
您最近一年使用:0次



