2021·山东·高考真题
1 . X、Y为第三周期元素、Y最高正价与最低负价的代数和为6,二者形成的一种化合物能以[XY4]+[XY6]-的形式存在。下列说法错误的是
| A.原子半径:X>Y | B.简单氢化物的还原性:X>Y |
| C.同周期元素形成的单质中Y氧化性最强 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2021-06-29更新
|
13121次组卷
|
35卷引用:查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)
(已下线)查补易混易错点06 物质结构 元素周期律-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)浙江省温州新力量联盟2021-2022学年高二下学期期末联考化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)北京市清华大学附属中学2022-2023学年高三9月月考化学试题四川省遂宁市射洪中学2022-2023学年高二上学期第一次月考(10月)化学试题湖南省长沙市卓华高级中学2021-2022学年高二下学期期末考试化学试题四川省内江市第六中学2022-2023学年高二上学期期中考试化学试题四川省遂宁中学校2022-2023学年高二上学期期中考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题2021年新高考山东化学高考真题(已下线)课时25 原子结构-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)专题06 物质结构 元素周期律-备战2022年高考化学真题及地市好题专项集训【山东专用】江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高三上学期第二次月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题2021年湖北高考化学试题变式题11-192021年山东高考化学试题变式题1-10福建省福州第三中学2021-2022学年高三上学期第五次质量检测化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破天津市第四十七中学2022—2023学年高三上学期期末 阶段性学习检测化学试题天津市第四十七中学2022-2023学年高三上学期期末考试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第五章 物质结构与性质 元素周期律 第27讲 元素周期表和元素周期律湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题安徽省安庆市第一中学2022-2023学年高二下学期第一次月考化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二下学期第一次验收考试化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)专题07 元素周期表与元素周期律(已下线)专题07 元素周期表与元素周期律(已下线)考点07 元素周期律和元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
2021·江西·一模
名校
解题方法
2 . 某抗癌药物的结构简式如图所示,其中W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y同主族,Y、Z的最外层电子数之和是X的最外层电子数的2倍。下列叙述正确的是
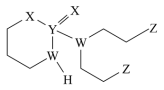

| A.W的最简单氢化物与Z的单质混合后可产生白烟 |
| B.最高价氧化物对应的水化物酸性强弱Y>Z |
| C.简单氢化物的沸点:W<Y<X |
| D.Y、Z形成的化合物中,每个原子均满足8电子结构 |
您最近一年使用:0次
2021-03-01更新
|
2522次组卷
|
10卷引用:专题09 物质结构 元素周期律-2022年高考化学二轮复习重点专题常考点突破练
(已下线)专题09 物质结构 元素周期律-2022年高考化学二轮复习重点专题常考点突破练广东省广东实验中学2021-2022学年高一下学期期中考试化学试题甘肃省武威第六中学 2022~2023学年高三上学期第二次阶段性考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高二上学期期中考试化学试题江西省重点中学协作体2020-2021学年高三下学期第一次联考理综化学试题(已下线)学科网2021年高三3月大联考考后强化卷(新课标Ⅰ卷)河北省武邑中学2021届高三二模化学试题江西省赣州市赣县第三中学2021-2022学年高三上学期10月月考化学试题广东省广州市中山大学附属中学2021届高三下学期3月月考化学试题 湖北省恩施市第一中学2022-2023学年高二下学期期中考试化学试题
名校
解题方法
3 . 短周期元素X、Y、Z、W的原子序数递增,且Z为金属元素,X、W同主族。单质X、Z、W可分别与单质Y化合生成最高价化合物甲、乙、丙。结合如图转化关系,下列判断正确的是
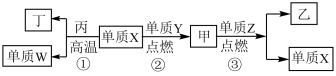

A.反应①可表示为 | B.X位于元素周期表第二周期V主族 |
| C.甲、丙、丁均为酸性氧化物 | D.乙的电子式为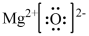 |
您最近一年使用:0次
2022-04-23更新
|
1007次组卷
|
3卷引用:湖北省鄂东南联盟学校2021-2022学年高一下学期期中联考化学试题
名校
解题方法
4 . 化合物( )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下分解时无刺激性气体逸出。下列叙述错误的是
分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下分解时无刺激性气体逸出。下列叙述错误的是

 )可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21,
)可用于电讯器材、高级玻璃的制造。W、X、Y、Z为短周期元素,原子序数依次增加,且加和为21, 分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下分解时无刺激性气体逸出。下列叙述错误的是
分子的总电子数为奇数,常温下为气体。该化合物的热重曲线如图所示,在200℃以下分解时无刺激性气体逸出。下列叙述错误的是
| A.W与Y可形成既含极性键也含非极性键的化合物 |
B.最高价氧化物的水化物的酸性: |
C.最简单气态氢化物的稳定性顺序为: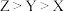 |
D.100~200℃阶段热分解的化学方程式为: |
您最近一年使用:0次
2022-11-25更新
|
850次组卷
|
4卷引用:河南省三门峡市2022-2023学年高三上学期11月阶段性考试化学试题
河南省三门峡市2022-2023学年高三上学期11月阶段性考试化学试题 (已下线)热点情景汇编-专题九 物质结构与性质河南省洛阳市新安县第一高级中学2022-2023学年高三上学期12月线上考试(实验班)化学试题(已下线)仿真卷04-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
名校
5 . 化合物甲是一种具有强还原性的无机物,其结构式如图所示(图中的“—”可表示单键或双键),其中W、X、Y、Z为元素周期表中原子序数 且核电荷数依次增大的主族元素,W和Z为同主族元素,这四种元素原子的最外层电子数之和为13,下列叙述错误的是
且核电荷数依次增大的主族元素,W和Z为同主族元素,这四种元素原子的最外层电子数之和为13,下列叙述错误的是

 且核电荷数依次增大的主族元素,W和Z为同主族元素,这四种元素原子的最外层电子数之和为13,下列叙述错误的是
且核电荷数依次增大的主族元素,W和Z为同主族元素,这四种元素原子的最外层电子数之和为13,下列叙述错误的是
A.原子半径: |
B.非金属性: |
| C.Y、Z两种元素对应的单质均能保存在煤油中 |
D.W、Y、Z与X形成的常见化合物熔点: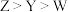 |
您最近一年使用:0次
6 . 五种前四周期的元素X、Y、Z、Q、W的原子序数依次增大。基态X原子的电子层数、能级数目和轨道数目均相等,Y与X可形成 、
、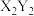 两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为
两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为 ,下列有关说法错误的是
,下列有关说法错误的是
 、
、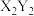 两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为
两种无色化合物,基态Z原子的M电子层上P轨道为半充满状态,Y、Q同主族,基态Q原子的M层有6种运动状态不同的电子,W原子的特征电子构型为 ,下列有关说法错误的是
,下列有关说法错误的是| A.Y、Z、Q三种元素的电负性大小关系为Q>Z>Y |
| B.X、Y、W三种元素形成的某化合物,可存在于碱性电池中 |
| C.最高价氧化物对应水化物的酸性:Q>Z |
| D.元素对应的离子半径大小关系为Z>Q>Y>X |
您最近一年使用:0次
2022-12-28更新
|
826次组卷
|
2卷引用:广东省汕头市普通高中2022-2023学年高三上学期教学质量检测化学试题
19-20高一上·天津静海·期末
名校
解题方法
7 . 几种短周期元素的主要化合价及原子的原子半径数据见下表:
据表中信息判断,下列有关叙述中,正确的是
| 元素代号 | L | M | Q | R | T |
| 主要化合价 | +2 | +3 | +6、﹣2 | +7、﹣1 | ﹣2 |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈 |
| B.M与T形成的化合物能和强酸、强碱反应且产物不同 |
| C.Q、T两元素的氢化物热稳定性比较:Q的氢化物大于T的氢化物 |
| D.L与R两元素形成的化合物中,含有非极性共价键 |
您最近一年使用:0次
2020-01-11更新
|
2830次组卷
|
12卷引用:第12练 原子结构与元素周期表-2022年【寒假分层作业】高一化学(人教版2019)
(已下线)第12练 原子结构与元素周期表-2022年【寒假分层作业】高一化学(人教版2019)福建省莆田第一中学2021-2022学年高一下学期期初学科素养能力竞赛化学试题江西省景德镇市第一中学2021-2022学年高二上学期期末(重点班)化学试题黑龙江牡丹江农管局密山农垦子弟学校2021-2022学年高一上学期期末考试化学试题天津市静海区第一中学2019-2020学年高一上学期期末学生学业能力调研化学试题山东省济宁市微山县第一中学2019-2020学年高一下学期网络课堂第一阶段网络测试化学试题河北省石家庄实验中学2019-2020学年高一3月月考化学试题湖北省武汉市第十一中学2019-2020学年高一下学期期中测试化学试题 内蒙古北京八中乌兰察布分校2019-2020学年高一下学期期末考试化学试题(已下线)4.2.1 元素性质的周期性变化规律(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.2.1 元素性质的周期性变化规律-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)山东省临沂第一中学文峰校区2022-2023学年高一上学期期末考试化学试题
2020·福建泉州·模拟预测
名校
8 . 短周期主族元素X、Y、Z和W的原子序数依次增大,X、Y、W位于不同周期,Y、Z、W的原子最外层电子数之和为14,Z的原子半径在短周期主族元素中最大。下列说法错误的是( )
| A.简单离子半径:W>Z>X |
| B.W的最高价氧化物对应的水化物为强酸 |
| C.Y与Z形成的化合物溶于水所得溶液呈碱性 |
| D.与X形成的简单化合物的还原性:Y>Z>W |
您最近一年使用:0次
2020-04-03更新
|
2677次组卷
|
4卷引用:押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)
(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)江西省安义中学2022-2023学年高三上学期中考试化学试题福建省泉州市2020届高三下学期3月适应性线上测试卷理综化学试题解题达人.化学选择题(2021全国卷)提升小卷16
名校
解题方法
9 . 现有A、B、C、D、E、F、G、H、I九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同运动状态的电子。
(3)某同学推断E元素基态原子的核外电子轨道表示式为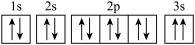 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电高能大于F元素原子的第一电离能的原因:_______ 。
(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为_______ 。
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ ;已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
(7)I位于元素周期表中____ 区(按电子排布分区),实验室检验I3+的离子方程式为:____ 。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
(7)I位于元素周期表中
您最近一年使用:0次
名校
解题方法
10 . 短周期元素X、Y、Z、W是同周期主族元素,W元素形成的某种单质具有强氧化性,可用于杀菌消毒。四种元素与锂组成的盐是一种新型的锂离子电池的电解质,结构如图所示(→表示配位键),下列说法正确的是


| A.原子半径:X>Y> Z> W |
| B.图中阴离子部分中四种元素均满足8电子稳定结构 |
| C.单质氧化性:W2> X2 |
| D.Y的最高价氧化物的水化物为强酸 |
您最近一年使用:0次



