名校
解题方法
1 . 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B原子的最外层电子数是次外层电子数的2倍,C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)D在周期表中的位置是___ ,写出实验室制备单质F的离子方程式___ 。
(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:___ 。
(3)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是__ (用元素离子符号表示)。
(4)元素B和F的非金属性强弱,B的非金属性___ 于F(填“强”或“弱”),并用化学方程式证明上述结论__ 。
II.以CA3代替氢气研发燃料电池是当前科研的一个热点。
(5)CA3燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为: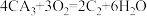 .该电池负极的电极反应式为
.该电池负极的电极反应式为___ ;每消耗3.4gCA3转移的电子数目为___ 。
(1)D在周期表中的位置是
(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:
(3)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是
(4)元素B和F的非金属性强弱,B的非金属性
II.以CA3代替氢气研发燃料电池是当前科研的一个热点。
(5)CA3燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:
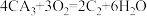 .该电池负极的电极反应式为
.该电池负极的电极反应式为
您最近半年使用:0次
2021-05-27更新
|
251次组卷
|
2卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
名校
2 . 某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是
| A.X的最高价含氧酸的分子式可表示为H3XO4 |
| B.X是第二周期ⅤA族元素 |
| C.X是第二周期ⅥA族元素 |
| D.X的最高正化合价为+4 |
您最近半年使用:0次
2021-04-19更新
|
345次组卷
|
19卷引用:黑龙江省齐齐哈尔市第八中学2018-2019学年高一下学期3月月考化学试题
黑龙江省齐齐哈尔市第八中学2018-2019学年高一下学期3月月考化学试题(已下线)2012年鲁科版高中化学必修2 1.2元素周期律和元素周期表练习卷(已下线)2013-2014学年山东省济宁市嘉祥一中高一3月质检化学试卷河北省唐山市开滦第二中学2017-2018学年高一4月月考化学试题【全国百强校】河北省邢台市第一中学2018-2019学年高一下学期第一次月考化学试题福建省福州市福清市华侨中学2018-2019学年高一下学期期中考试化学试题【校级联考】江西省赣州市五校协作体2018-2019学年高一下学期期中联考化学试题甘肃省武威第十八中学2018-2019学年高一下学期期中考试化学试题新疆石河子第二中学2018-2019学年高一下学期第一次月考化学试题苏教版高一化学必修2专题1《微观结构与物质的多样性》测试卷人教版高一化学必修2第一章物质结构与元素周期律单元检测试题浙江省宁波市慈溪中学高一化学《物质结构 元素周期律》单元检测(实验班)福建省漳州市第一中学2019-2020学年高一3月在线测试(实验班)化学试题新疆乌鲁木齐市第八中学2020-2021学年高一下学期第一阶段考试化学试题云南省通海县一中2020-2021学年高一下学期期中考试化学试题(已下线)5.1.4 元素周期表的应用(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)天津市实验中学2022-2023学年高一上学期期末考试化学试题2014-2015学年湖北省荆州市松滋四中高二下学期6月月考化学试卷【全国市级联考】山东省菏泽市2017-2018学年高二下学期期中考试(B卷)化学试题
名校
解题方法
3 . 如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A.A、B简单离子半径大小关系为:B3+>A2+ |
| B.简单气态氢化物沸点:D>E |
| C.简单气态氢化物的稳定性:D<C |
| D.最高价氧化物对应的水化物的酸性:C>E |
您最近半年使用:0次
2020-12-08更新
|
301次组卷
|
3卷引用:黑龙江省大庆市东风中学2020-2021学年高一下学期开学考试化学试题
名校
4 . X、Y、Z、R是短周期主族元素,X元素是形成有机化合物的必需元素,Y元素原子的最外层电子数是次外层的三倍,Z元素的原子半径是短周期主族元素中最大的,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是( )
| A.X、R元素的非金属性:R>X |
| B.XY2是形成酸雨的主要污染物 |
| C.X、Z分别与R形成的化合物中化学键类型不同 |
| D.含有X、Y、Z三种元素的化合物的溶液可能显碱性 |
您最近半年使用:0次
2020-09-07更新
|
348次组卷
|
4卷引用:黑龙江省大庆市东风中学2020-2021学年高一下学期开学考试化学试题
解题方法
5 . A、B、C、D、E五种元素,已知:
①A原子的最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子的最外层上的电子数比最内层多5。
②常温下B2是气体,它的相对分子质量是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:
(1)E位于第___ 周期___ 族;
(2)C的离子结构示意图是_____ ,F中的化学键为______ ;
(3)AB2的电子式为___ ; F和AB2反应的化学方程式为_______ ;
(4)C、D、E三种元素的原子半径从小到大的顺序为___ ; (用元素符号回答)
(5)常温下,E的单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式为__________ 。
①A原子的最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子的最外层上的电子数比最内层多5。
②常温下B2是气体,它的相对分子质量是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:
(1)E位于第
(2)C的离子结构示意图是
(3)AB2的电子式为
(4)C、D、E三种元素的原子半径从小到大的顺序为
(5)常温下,E的单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式为
您最近半年使用:0次
解题方法
6 . a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________ 。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________ (用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________ ,实验室制备d气体的化学方程式为________ ;若d为正四面体形分子,其重要应用之一为________ 。
(4)c粒子是________ ,f粒子是________ (用化学式表示),由c、f生成g的离子方程式是________ 。
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
(1)a粒子的原子结构示意图是
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为
(3)若d极易溶于水,在水溶液中变化的方程式为
(4)c粒子是
您最近半年使用:0次
2020-01-20更新
|
37次组卷
|
2卷引用:黑龙江省大兴安岭漠河县第一中学2018-2019学年高一上学期期中考试化学试题
名校
解题方法
7 . A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A_______ ,B________ ,C________ ,D________ ,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
(1)写出下列元素符号:A
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
您最近半年使用:0次
2019-06-23更新
|
106次组卷
|
2卷引用:黑龙江省牡丹江市第三高级中学2018-2019学年高一下学期期中考试化学试题
18-19高一下·黑龙江哈尔滨·期中
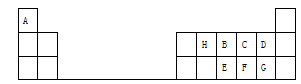
8 . 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
(1)画出C的原子结构示意图___________________ 。
(2)E在元素周期表中的位置是_____________________ 。
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是_____________ (填化学式)。
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是_____________ (填化学式)。
(5)A、B、G三元素形成的化合物的电子式是________ ,其中所含的化学键类型_____ 。
(6)B、C、D元素简单离子的半径由大到小的顺序:___________________ 。
(7)H元素的最简单气态氢化物的分子构型为_______________ ,键角为____________ 。
(1)画出C的原子结构示意图
(2)E在元素周期表中的位置是
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是
(5)A、B、G三元素形成的化合物的电子式是
(6)B、C、D元素简单离子的半径由大到小的顺序:
(7)H元素的最简单气态氢化物的分子构型为
您最近半年使用:0次
18-19高一下·黑龙江哈尔滨·期中
9 . 下图为周期表中短周期的一部分,若A原子的最外电子层上有5个电子,则下列说法中不正确的
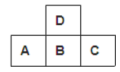
| A.C的单质可跟B的氢化物的水溶液反应 |
| B.A的最高价氧化物的水化物比B的最高价氧化物的水化物的酸性弱 |
| C.B的氢化物比C的氢化物稳定 |
| D.原子半径A>B>C |
您最近半年使用:0次
解题方法
10 . 有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下产生2.8L氢气和 0.25 mol ACln;B的气态氢化物的分子式为 H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1: 2.88,B原子核内质子数与中子数相等;C和B可形成液态化合物 CB2,并能溶解B的单质。试回答下列问题:
(1)A、B、C的名称分别是______ 、______ 、________ ;
(2) A离子的结构示意图为_______ ; B在周期表中的位置为_______ ;CB2的分子式为_______ 。
(3)A与B形成的化合物的化学式为_________
(4)B的最高价氧化物的水化物的化学式为_________ ,
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:__________________
(1)A、B、C的名称分别是
(2) A离子的结构示意图为
(3)A与B形成的化合物的化学式为
(4)B的最高价氧化物的水化物的化学式为
(5)写出B的气态氢化物与B的低价氧化物反应生成淡黄色固体的化学方程式:
您最近半年使用:0次



