名校
1 . Ⅰ.某元素的核素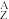 X,1.11 g该核素的氯化物XCl2配成的溶液需用20 mL 1 mol·L-1的AgNO3溶液才能把Cl-完全沉淀下来,已知此核素中质子数与中子数相等,则:
X,1.11 g该核素的氯化物XCl2配成的溶液需用20 mL 1 mol·L-1的AgNO3溶液才能把Cl-完全沉淀下来,已知此核素中质子数与中子数相等,则:
(1)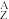 X的质量数A是
X的质量数A是___________ 。
(2)111g XCl2中所含质子数的物质的量为___________ 。
Ⅱ.向VmL 3mol L-1的NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴入1mol
L-1的NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
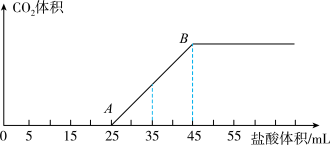
(3)所得溶液中的溶质是___________ ,其物质的量之比为___________ ;
(4)当加入35mL盐酸溶液时,产生二氧化碳的物质的量为___________ mol;
(5)计算所取氢氧化钠溶液的体积V=___________ mL。
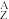 X,1.11 g该核素的氯化物XCl2配成的溶液需用20 mL 1 mol·L-1的AgNO3溶液才能把Cl-完全沉淀下来,已知此核素中质子数与中子数相等,则:
X,1.11 g该核素的氯化物XCl2配成的溶液需用20 mL 1 mol·L-1的AgNO3溶液才能把Cl-完全沉淀下来,已知此核素中质子数与中子数相等,则:(1)
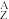 X的质量数A是
X的质量数A是(2)111g XCl2中所含质子数的物质的量为
Ⅱ.向VmL 3mol
 L-1的NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴入1mol
L-1的NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴入1mol L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示: 
(3)所得溶液中的溶质是
(4)当加入35mL盐酸溶液时,产生二氧化碳的物质的量为
(5)计算所取氢氧化钠溶液的体积V=
您最近半年使用:0次
名校
2 . 填空
(1)3.01×1023个H2O的物质的量为___________ mol,其中,所含电子的数目为___________ 。
(2)在同温同压下,等质量的CO和CO2,其体积之比为___________ 。
(3)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为___________ 。
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为___________ 。
(5)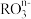 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是___________ 。
(1)3.01×1023个H2O的物质的量为
(2)在同温同压下,等质量的CO和CO2,其体积之比为
(3)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为
(5)
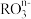 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
您最近半年使用:0次
名校
解题方法
3 . N 、N
、N 等一系列含氮微粒均已被发现,一个N
等一系列含氮微粒均已被发现,一个N 中含
中含_______ 个电子;8.4gN 中含
中含________ mol质子。
 、N
、N 等一系列含氮微粒均已被发现,一个N
等一系列含氮微粒均已被发现,一个N 中含
中含 中含
中含
您最近半年使用:0次
名校
4 . 填空
(1)3.01×1023个H2O的物质的量为___________ mol,其中,所含原子的物质的量为___________ mol,所含电子的物质的量为___________ mol。
(2)___________ gH2O中的氧原子数目与标准状况下22.4LCO2中的氧原子数目相同。
(3)2gNaOH溶于水配制成___________ mL溶液时其物质的量浓度为2mol/L。
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为___________
(5)电解1.8gH2O所得的H2在标准状况下的体积为___________
(6)标准状况下,2molNH3与___________  CO2的体积相等。
CO2的体积相等。
(7)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为___________
(8)在同温同压下,等质量的CO和CO2,其体积之比为___________ 。
(9)某元素的一种同位素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX分子中含质子的物质的量是___________ 。
(10)在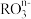 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是___________
(1)3.01×1023个H2O的物质的量为
(2)
(3)2gNaOH溶于水配制成
(4)某硫酸铝溶液中所含铝离子浓度为3mol/L,则硫酸根离子浓度为
(5)电解1.8gH2O所得的H2在标准状况下的体积为
(6)标准状况下,2molNH3与
 CO2的体积相等。
CO2的体积相等。(7)33.3g某金属氯化物MCl2中含有0.6molCl-,则该氯化物的摩尔质量为
(8)在同温同压下,等质量的CO和CO2,其体积之比为
(9)某元素的一种同位素X的质量数为A,含N个中子,它与1H原子组成HmX分子,在agHmX分子中含质子的物质的量是
(10)在
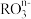 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是
您最近半年使用:0次
2023-10-23更新
|
322次组卷
|
2卷引用:福建师范大学附属中学2023-2024学年高一上学期期中练习卷化学试题
5 . 回答下列问题:
(1)某金属氯化物MCl2 40.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是_______ 。
(2)现有11g 2H218O 分子的物质的量为_______ mol,其中含中子数为_______ mol,电子数为_______ 个。
(1)某金属氯化物MCl2 40.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是
(2)现有11g 2H218O 分子的物质的量为
您最近半年使用:0次
6 . 由于原子核外电子排布的周期性变化,使得元素的性质也呈现了周期性的变化,如,原子半径、主要化合价、元素的金属性和非金属性等。
(1)已知氢元素有三种核素:1H、2H、3H,氯有2种核素35Cl、37Cl。则氯气与氢气形成的氯化氢分子的相对分子质量有_______ 种。
(2)质量相同的 和
和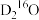 所含质子数之比为
所含质子数之比为_______ ,中子数之比为_______ 。
(1)已知氢元素有三种核素:1H、2H、3H,氯有2种核素35Cl、37Cl。则氯气与氢气形成的氯化氢分子的相对分子质量有
(2)质量相同的
 和
和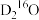 所含质子数之比为
所含质子数之比为
您最近半年使用:0次
解题方法
7 . 回答下列问题:
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:_______ 。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
试根据表中所列键能数据估算a的数值_______ 。
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:_______ 。
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为_______ 。
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 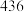 | 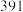 | 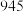 |
试根据表中所列键能数据估算a的数值
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为
您最近半年使用:0次
8 . 根据所学知识填空:
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为_______ 。
(2)1.7 g NH3与标准状况下_______ L H2S含有相同数目的氢原子。
(3)0.17 g OH-中质子的物质的量为_______ ,电子的微粒数为_______ 个。
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为_______ 。
(1)16 g物质A中含有的分子数为3.01×1023,则A的摩尔质量为
(2)1.7 g NH3与标准状况下
(3)0.17 g OH-中质子的物质的量为
(4)某气体在标准状况下的密度为1.25 g/L,则14 g该气体所含有的分子数为
您最近半年使用:0次
名校
9 . 回答下列问题:
(1)在下列物质中,可以导电的是_______ (填序号,下同),是电解质的有_______ 。
①氯化钠晶体②熔融的氢氧化钠③Cu④酒精⑤Na2SO4溶液⑥液氨⑦稀盐酸⑧BaSO4晶体
(2)某气体在标准状况下的密度为1.25g/L,则14g该气体所含有的物质的量为_______ 。
(3)从400mL2.0mol·L-1的Al2(SO4)3溶液中取出10mL,将这10mL溶液用水稀释到100mL,所得溶液中 的物质的量浓度为
的物质的量浓度为_______ mol·L-1。
(4)已知Mm+与Nn-具有相同的电子层结构(核外电子排布相同),若N的核电荷数为a,M的质量数为A,则M的中子数为_______ 。
(1)在下列物质中,可以导电的是
①氯化钠晶体②熔融的氢氧化钠③Cu④酒精⑤Na2SO4溶液⑥液氨⑦稀盐酸⑧BaSO4晶体
(2)某气体在标准状况下的密度为1.25g/L,则14g该气体所含有的物质的量为
(3)从400mL2.0mol·L-1的Al2(SO4)3溶液中取出10mL,将这10mL溶液用水稀释到100mL,所得溶液中
 的物质的量浓度为
的物质的量浓度为(4)已知Mm+与Nn-具有相同的电子层结构(核外电子排布相同),若N的核电荷数为a,M的质量数为A,则M的中子数为
您最近半年使用:0次
名校
10 . 用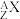 表示原子:
表示原子:
(1)中性原子的中子数N=___________ 。
(2) 共有x个电子,则该阳离子的中子数N=
共有x个电子,则该阳离子的中子数N=___________ 。
(3)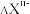 共有x个电子,则该阴离子的中子数N=
共有x个电子,则该阴离子的中子数N=___________ 。
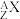 表示原子:
表示原子:(1)中性原子的中子数N=
(2)
 共有x个电子,则该阳离子的中子数N=
共有x个电子,则该阳离子的中子数N=(3)
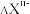 共有x个电子,则该阴离子的中子数N=
共有x个电子,则该阴离子的中子数N=
您最近半年使用:0次
2021-11-23更新
|
1887次组卷
|
4卷引用:江苏省淮安市高中校协作体2021-2022学年高一上学期期中考试化学试题
江苏省淮安市高中校协作体2021-2022学年高一上学期期中考试化学试题河南省平顶山市龙河实验高级中学2021-2022学年高一上学期12月月考化学试题(已下线)4.1.1 原子结构 核素-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)甘肃省天水市秦安县第一中学2022-2023学年高一上学期期末考试化学试题



