解题方法
1 . 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外电子排布式为___ 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___ (填序号)。
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液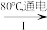 NaClO3溶液
NaClO3溶液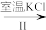 KClO3晶体
KClO3晶体
II中转化的基本反应类型是___ ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
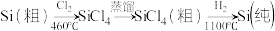
写出SiCl4的电子式:___ ;在上述由SiCl4制纯硅的反应中,测得生成7kg纯硅需吸收akJ热量,写出该反应的热化学方程式:___ 。
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目___ 。
(1)与氯元素同族的短周期元素的原子核外电子排布式为
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是
a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如图转化可制得KClO3晶体:
NaCl溶液
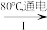 NaClO3溶液
NaClO3溶液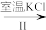 KClO3晶体
KClO3晶体II中转化的基本反应类型是
(4)晶体硅(熔点1410℃)是良好的半导体材料;四氯化硅熔点-70℃,沸点57.6℃;由粗硅制纯硅过程如图:
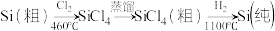
写出SiCl4的电子式:
(5)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并用单线桥标出电子转移的方向和数目
您最近一年使用:0次
解题方法
2 . (1)写出符合下列条件的原子的元素符号并画出其原子结构示意图。
①核外有2个电子层、10个电子的原子__________________ ;
②质量数为23、中子数为12的原子__________________ ;
③电子总数是最外层电子数3倍的原子__________________ 。
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.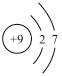 B.
B.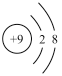 C.
C.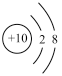 D.
D.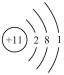
①电子层排布相同的是__________________ ;
②属于同一种元素的是__________________ ;
③属于金属元素的是__________________ ;
④属于稀有气体元素的是__________________ 。
①核外有2个电子层、10个电子的原子
②质量数为23、中子数为12的原子
③电子总数是最外层电子数3倍的原子
(2)用下列原子或离子的结构示意图的编号(A、B、C、D)填空:
A.
 B.
B. C.
C. D.
D.
①电子层排布相同的是
②属于同一种元素的是
③属于金属元素的是
④属于稀有气体元素的是
您最近一年使用:0次
解题方法
3 . 填表
| 微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
 Cl Cl | ||||
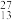 Al Al | ||||
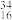 S2- S2- |
您最近一年使用:0次
4 . 化学用语表示:
(1)根据下列几种粒子的结构示意图,回答问题:
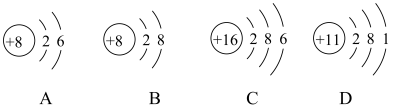
①写出B微粒的符号_________ ;
②若A微粒的中子数为10,写出表示A微粒的组成符号________ ;
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:_________ ;
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热____________ ;
②工业上制备氯气____________ 。
(1)根据下列几种粒子的结构示意图,回答问题:

①写出B微粒的符号
②若A微粒的中子数为10,写出表示A微粒的组成符号
③写出A、C、D三种元素形成的某种化合物在水溶液中的电离方程式:
(2)写出下列反应的化学方程式:
①氯化铵与氢氧化钠共热
②工业上制备氯气
您最近一年使用:0次
5 . 某元素单质R质量为5.4g,跟足量的氯气反应可生成RCl3质量为26.7g,已知R原子中质子数比中子数少一个。
(1)求R的相对原子质量;___
(2)写出R的原子结构示意图和R离子的电子式。___ 、___
(1)求R的相对原子质量;
(2)写出R的原子结构示意图和R离子的电子式。
您最近一年使用:0次
6 . 某微粒的结构示意图如图所示:
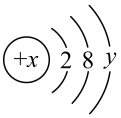
(1)x表示_________________ ,y表示______________________
(2)当y = 7时,若该微粒为中性原子,则x =______________ 。
(3)当y = 8时,若该微粒带有两个单位负电荷,则该微粒的表示符号为_______________ ;若该微粒带有一个单位正电荷,则该微粒的表示符号为________________ 。

(1)x表示
(2)当y = 7时,若该微粒为中性原子,则x =
(3)当y = 8时,若该微粒带有两个单位负电荷,则该微粒的表示符号为
您最近一年使用:0次
解题方法
7 . 金属“钙线”是炼制优质钢材的脱氧脱磷剂,某“钙线”的主要成分为金属M和Ca。
(1)Ca元素在元素周期表中的位置是_____ ,最外层电子排布式为________ 。
(2)CaF2的电子式为_____ ,CaF2熔点比SiF4熔点_______ (选填“高”、“低”或“相同”),原因是_____ 。
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为_____ ,检测Mn+的另一种方法是_____ 。
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,________ ,若生成的Fe为2.8g,则转移的电子数目为_____ 个。
(1)Ca元素在元素周期表中的位置是
(2)CaF2的电子式为
(3)将“钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为
(4)配平下列化学方程式: P+ FeO+ CaO→ Ca3(PO4)2+ Fe,
您最近一年使用:0次
8 . 观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
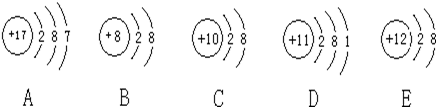
(1)属于离子结构示意图的是______ 、______ (填编号)。
(2)性质最稳定的原子是(填写编号,在本小题中下同)______ ,最容易失去电子的原子是______ ,最容易得到电子的原子是______ 。
(3)A、D两种元素形成的化合物在水溶液中的电离方程式______ 。
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号______ 、______ 。

(1)属于离子结构示意图的是
(2)性质最稳定的原子是(填写编号,在本小题中下同)
(3)A、D两种元素形成的化合物在水溶液中的电离方程式
(4)在核电荷数1-18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号
您最近一年使用:0次
2019-01-27更新
|
542次组卷
|
7卷引用:2011-2012学年江苏省江阴市一中高一上学期期中考试化学试卷
(已下线)2011-2012学年江苏省江阴市一中高一上学期期中考试化学试卷陕西省黄陵中学2018-2019学年高一(普通班)上学期期末考试化学试题(已下线)2019年4月1日《每日一题》 必修2 原子的组成与结构第1章原子结构与元素周期律第1节易错疑难集训(一)鲁科版(2019)必修第二册第一章第1节 易错疑难集训(已下线)2.3.2 原子核外电子排布练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)2.3.2 原子核外电子排布-2021-2022学年高一化学10分钟课前预习练(苏教版2019必修第一册)
9 . 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的 L 层电子数为___________ ;
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为____ 。
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为_____ 。
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式:____ 。
(1)氮元素原子的 L 层电子数为
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式:
您最近一年使用:0次
名校
10 . 按要求填写:
(1)二氧化碳的电子式:______________ ;小苏打的化学式:________________ ;质子数为6、中子数为6的原子结构示意图____________________ 。
(2)氯气与氢氧化钠溶液反应的化学方程式______________________________ 。
(1)二氧化碳的电子式:
(2)氯气与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次



