名校
解题方法
1 . 下列物质中,只含有共价键的是
| A.KOH | B.Na2S | C.HCl | D.MgO |
您最近一年使用:0次
2020-11-19更新
|
156次组卷
|
3卷引用:河北省邯郸市曲周县第一中学2020-2021学年高一下学期开学考试化学试题
名校
解题方法
2 . 原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请回答下 列问题:
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:
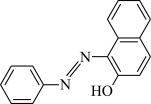
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:
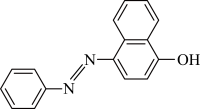
则其在水中的溶解度会_____ (填“增大”或“减小”),原因是_____ 。
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为_______ ,由 Cl-所形成的化学键类型是_______ 。
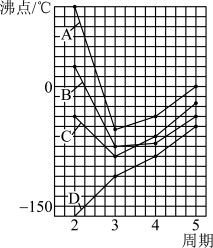
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是_____ ;表示ⅣA族元素氢化物沸点的曲线是_____ ;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是__________ ;A、B、C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是_______________ 。
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:

苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:

则其在水中的溶解度会
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是

您最近一年使用:0次
2020-04-06更新
|
162次组卷
|
3卷引用:河北省张家口宣化一中2020-2021学年高二下学期4月月考化学试题
3 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,Y原子最外层电子数是其内层电子总数的3倍,W原子的核电荷数等于X、Z原子核电荷数之和,X和Z同主族。下列说法正确的是
| A.原子半径:r(W)>r(Z)>r(Y) |
| B.Z的最高价氧化物对应水化物的碱性比W的强 |
| C.化合物X2Y2和Z2Y2所含化学键类型完全相同 |
| D.工业上常用电解熔融W的氯化物制备W的单质 |
您最近一年使用:0次
名校
4 . 下列晶体中,化学键种类相同,晶体类型也相同的是( )
| A.SO2和SiO2 | B.CO2和H2O | C.NaCl和HCl | D.Cl2和KCl |
您最近一年使用:0次
解题方法
5 . 下列物质中,既含有离子键又含有极性共价键的是( )
A. | B. | C. | D. |
您最近一年使用:0次
2020-05-19更新
|
144次组卷
|
2卷引用:河北省邢台市2019-2020学年高一下学期期中考试化学试题
6 . 用 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,4.6g由 和 和 组成的混合体中所含的质子总数为 组成的混合体中所含的质子总数为 |
B.9.6g 中含有共价键的总数为 中含有共价键的总数为 |
C.常温时,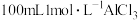 溶液中所含阳离子数目小于 溶液中所含阳离子数目小于 |
D.含有 阴离子的 阴离子的 和足量 和足量 充分反应,转移的电子数为 充分反应,转移的电子数为 |
您最近一年使用:0次
名校
解题方法
7 . 下列物质中,既含有离子键又含有极性共价键的是
| A.HCl | B.NH4Cl | C.H2O2 | D.H2 |
您最近一年使用:0次
2020-04-29更新
|
150次组卷
|
2卷引用:河北省承德市隆化县存瑞中学2019--2020学年高一下学期期中考试化学试题
名校
8 . 下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是
| A.NH4Cl + NaOH = NaCl + NH3↑ + H2O | B.Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3↑ |
| C.Cl2 + 2NaOH = NaClO + NaCl + H2O | D.2Na2O2 + 2H2O = NaOH + O2↑ |
您最近一年使用:0次
2018-08-09更新
|
267次组卷
|
8卷引用:河北省正定中学2016-2017学年高二下学期第二次月考(期中)化学试题
河北省正定中学2016-2017学年高二下学期第二次月考(期中)化学试题河北省定州中学2016-2017学年高一(承智班)下学期期末考试化学试题【全国百强校】广东省深圳市南山区深圳实验学校高中部2017-2018学年高一下学期第一次阶段考试化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期3月月考化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高一下学期期中考试化学试题福建省永春县第一中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区克拉玛依市第十三中学2018-2019学年高一(实验班)下学期期中模拟考试化学试题宁夏回族自治区银川一中2019-2020学年高一下学期期中考试化学试题
解题方法
9 . 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。请回答下列问题:
(1)Y元素的名称________ ;
(2)W在元素周期表中的位置是第________ 周期第________ 族;
(3)X2M2中存在的化学键有________ 、________ ;
(4)Z、W氢化物的稳定性顺序为________ 。(用化学式表示)
(1)Y元素的名称
(2)W在元素周期表中的位置是第
(3)X2M2中存在的化学键有
(4)Z、W氢化物的稳定性顺序为
您最近一年使用:0次
2018-06-23更新
|
254次组卷
|
3卷引用:河北省衡水市景县梁集中学2017-2018学年高一下学期期中考试化学试题
名校
10 . 下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤含有离子键的化合物一定是离子化合物 ⑥离子化合物中可能同时含有离子键和共价键
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤含有离子键的化合物一定是离子化合物 ⑥离子化合物中可能同时含有离子键和共价键
| A.④⑥ | B.②③⑤ | C.①③④ | D.④⑤⑥ |
您最近一年使用:0次
2019-07-16更新
|
210次组卷
|
24卷引用:河北省深州市长江中学2018-2019学年高一下学期期末考试化学试题
河北省深州市长江中学2018-2019学年高一下学期期末考试化学试题河北省承德第一中学2019-2020学年高二上学期开学考试化学试题河北省深州市长江中学2019-2020学年高一下学期期末考试化学试题2014-2015学年四川省双流县棠湖中学高一下期中化学试卷2014-2015学年吉林省长春外国语学校高一下期末化学试卷12014-2015学年吉林省长春外国语学校高一下期末化学试卷2云南省腾冲市第八中学2017-2018学年高一下学期期末考试化学试题【全国百强校】河南省洛阳市第一中学2018-2019学年高一下学期3月月考化学试题陕西省渭南尚德中学2018-2019学年高一下学期第一次月考化学试题黑龙江省大庆十中2018-2019学年高一下学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期末考试化学试题陕西省渭南市韩城市象山中学2019-2020学年高一下学期第一次月考化学试题(已下线)专题5.3 化学键(练)——2020年高考化学一轮复习讲练测甘肃省岷县第二中学2020-2021学年高一下学期第一次月考化学试题甘肃省兰州市教育局第四片区2020-2021学年高一下学期期中考试化学试题青海省西宁市海湖中学2021-2022学年高二上学期开学考试化学试题天津市红桥区2018-2019学年高一下学期学业水平合格模拟考试化学试题云南省丘北县第一中学2021-2022学年高一下学期2月月考化学试题云南省宣威市第三中学2021-2022学年高一下学期3月份考试化学试题天津市红桥区2020-2021学年高一上学期期末考试化学试题湖南省邵阳市隆回县2022-2023学年高一上学期期末考试化学试题云南省昆明市2022-2023学年高一下学期开学考试化学试题山东省曹县第一中学2022-2023学年高一下学期2月月考化学试题黑龙江省富锦市第一中学2022-2023学年高一下学期第二次考试化学试题



