名校
1 . A、B、C、D、E、F、G为短周期元素,原子序数依次增大。A、B两元素最高正价和最低负价代数和为零;D是地壳中含量最高的非金属元素;E和A同主族,G与D同主族;E、F、G的最高价氧化物的水化物两两之间可以反应。
(1)G元素的名称是__________ ,其在周期表中的位置是_____________ ,其离子结构示意图为_____________ 。
(2)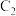 的电子式
的电子式_____________ ;由A、C原子个数比为5∶1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为_____________ 。
(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为_____________ (用分子式表示,下同);D和G的简单氢化物沸点的由高到低的顺序为_____________ 。
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式________________ 。
(5)由C、E组成的一种离子化合物的化学式为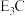 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)_________________________ ;该化合物遇水剧烈反应,有刺激性气味的气体生成,该反应的化学方程式为___________________________ 。
(1)G元素的名称是
(2)
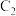 的电子式
的电子式(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式
(5)由C、E组成的一种离子化合物的化学式为
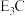 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
您最近一年使用:0次
名校
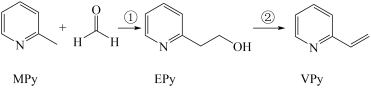
2 . I、吡啶(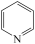 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为_______
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂_______ 个π键,形成_______ 个σ键。
(4)吡啶、 与
与 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
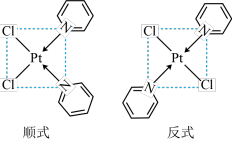
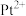 的配位数为
的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水_______ (填“能”或“否”),
Ⅱ、有下列实验:
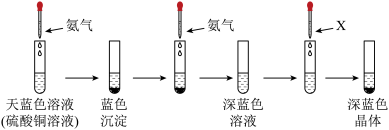
(5)该深蓝色晶体的化学式为_______ ,溶剂X可以是_______ (填名称),继续添加氨水,沉淀溶解,写出沉淀溶解的离子方程式为_______ 。
(6)该实验能说明 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是_______ 。
(7)下列有关化学实验“操作→现象→解释”均正确的是_______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为
(2)EPy晶体中微粒间的作用力类型有
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂
(4)吡啶、
 与
与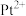 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
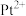 的配位数为
的配位数为Ⅱ、有下列实验:

(5)该深蓝色晶体的化学式为
(6)该实验能说明
 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是(7)下列有关化学实验“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 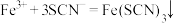 |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知 的配位数为6.则CrCl3·6H2O的化学式可表示为 的配位数为6.则CrCl3·6H2O的化学式可表示为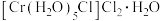 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加l0滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在: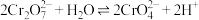 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
3 . A、X、Y、Z、R、W为六种短周期元素。A是短周期中半径最小的元素;X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价代数和为4;Z的单质常用于漂白工业;R是短周期元素中金属性最强的元素,W是生活中的常见金属,其氧化物常作耐高温材料。回答下列问题:
(1)Y元素的名称是___________ ,W在周期表中的位置是___________ 。
(2)写出化合物AZX的结构式:___________ ;化合物R2X2存在的化学键类型是___________ 。
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:___________ (用离子符号表示)。
(4)下列事实能证明非金属性Z比Y强的是___________ (填序号)。
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:___________ 。
(6)用电子式表示RZ的形成过程:___________ 。
(1)Y元素的名称是
(2)写出化合物AZX的结构式:
(3)X、Z、R三种元素对应的简单离子半径由大到小大小:
(4)下列事实能证明非金属性Z比Y强的是
a.简单阴离子还原性Z>Y
b.简单氢化物热稳定性:Z>Y
c.氧化物对应的水化物酸性:Z>Y
d.Y的简单氢化物的水溶液中通入Z的单质有沉淀析出
(5)写出实验室制备Z的单质的离子方程式:
(6)用电子式表示RZ的形成过程:
您最近一年使用:0次
2020-12-11更新
|
333次组卷
|
5卷引用:黑龙江省大庆市铁人中学2021届高三上学期期中考试化学试题
名校
解题方法
4 . 已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
(1)X、Z两种元素的元素符号为X________ ,Z________ 。
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为________________ 。
(3)①由X、Y、Z所形成的常见离子化合物是__________________ (写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为_______ 。
③化合物WY3的晶体结构中含有的化学键为________ (选填序号)。
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应生成X2,其中水作________ (填“氧化剂”或“还原剂”)。
(4)用电子式表示化合物W2Z的形成过程:______________________________________ 。
(1)X、Z两种元素的元素符号为X
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为
(3)①由X、Y、Z所形成的常见离子化合物是
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为
③化合物WY3的晶体结构中含有的化学键为
A.只含离子键 B.只含共价键 C.既含离子键又含共价键
④X与W形成的化合物与水反应生成X2,其中水作
(4)用电子式表示化合物W2Z的形成过程:
您最近一年使用:0次
2019-06-19更新
|
266次组卷
|
3卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期中考试化学试题
【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一下学期期中考试化学试题【全国百强校】吉林省长春市外国语学校2018-2019学年高一下学期第二次月考化学试题(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记
名校
5 . 已知四种短周期元素A、B、C、D的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别是同一主族的元素,B、D两元素原子的质子数之和是A、C两元素原子的质子数之和的二倍。请回答下列问题。
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_________________________ ,反应物的电子式是_________ ,其所含化学键为(选代码)___________ 。
a.离子键 b.极性共价键 c.非极性共价键
(2)以上四种元素中的部分元素之间形成的化合物,能使品红溶液褪色的物质有_______________ (填化学式)。
(3)由A、B、C、D四种元素组成的化合物甲和乙,它们水溶液相互反应的离子方程式为_______________________ 。
(1)由A、B两种元素可形成E、F两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:
a.离子键 b.极性共价键 c.非极性共价键
(2)以上四种元素中的部分元素之间形成的化合物,能使品红溶液褪色的物质有
(3)由A、B、C、D四种元素组成的化合物甲和乙,它们水溶液相互反应的离子方程式为
您最近一年使用:0次
2019-03-27更新
|
207次组卷
|
2卷引用:黑龙江省鸡西市鸡东县第二中学2019-2020学年高一下学期期末考试化学试题
名校
解题方法
6 . 有以下几种粒子:X、Y、Z是阳离子,Q是阴离子,M、N是分子.除Z外其余粒子都由短周期元素A、B、C中的一种或几种构成,且具有以下结构特征和性质:
①它们(X、Y、Z、Q、M、N)核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和Q都由A、B两元素组成,Y核内质子总数比Q多两个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和Q形成的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含Q的溶液,有白色沉淀生成,再加入过量的含Q或Y的溶液,沉淀消失.
(1)Q的化学式为______ ;X的电子式为______________ .
(2)试比较M和N的稳定性:N____ M;
(3)写出Z和N的水溶液反应的离子方程式___________________________ ;
(4)上述六种微粒中的两种阳离子可与硫酸根形成一种盐(不含结晶水),向该盐的浓溶液中逐滴加入0.2mol/L的NaOH溶液,出现了如图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为_______________ .

(5)将2.56g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到896mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积________ mL.
①它们(X、Y、Z、Q、M、N)核外电子总数都相同;
②N溶于M中,滴入酚酞,溶液变红;
③Y和Q都由A、B两元素组成,Y核内质子总数比Q多两个;
④X和N都由A、C两元素组成,X和Y核内质子总数相等;
⑤X和Q形成的浓溶液在加热情况下生成M和N;
⑥Z为单核离子,向含有Z的溶液中加入少量含Q的溶液,有白色沉淀生成,再加入过量的含Q或Y的溶液,沉淀消失.
(1)Q的化学式为
(2)试比较M和N的稳定性:N
(3)写出Z和N的水溶液反应的离子方程式
(4)上述六种微粒中的两种阳离子可与硫酸根形成一种盐(不含结晶水),向该盐的浓溶液中逐滴加入0.2mol/L的NaOH溶液,出现了如图中a、b、c三个阶段的图象,根据图象判断该盐的化学式为

(5)将2.56g铜投入到一定量由A、B、C三种元素形成的一种常见化合物的溶液中,共收集到896mL气体(标准状况下),将盛有此气体的容器倒扣在水槽中,通入一定量的氧气,恰好使气体完全溶于水,则通入氧气在标准状况下的体积
您最近一年使用:0次
2017-06-28更新
|
340次组卷
|
2卷引用:黑龙江省肇东市第一中学2016-2017学年高一下学期期中考试化学试题



