1 . 几种主族元素在周期表中的位置如图
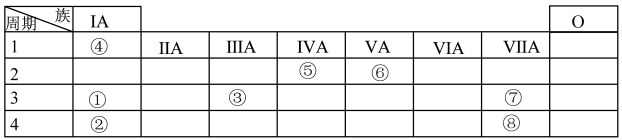
根据图表回答下列问题:
(1)⑥元素的氢化物的电子式是_______
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是_______ ,其最高价氧化物对应的水化物所含的化学键有_______
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式);①与③最高价氧化物对应水化物反应的离子方程式为_______ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。

根据图表回答下列问题:
(1)⑥元素的氢化物的电子式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。
| A.⑦的氢化物比⑧的氢化物稳定 |
| B.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性 |
| C.⑦的单质能将⑧从其钠盐溶液中置换出来 |
| D.⑦的氢化物酸性比⑧的氢化物酸性弱 |
您最近一年使用:0次
名校
2 . 下表显示了元素周期表中短周期的一部分,A~G代表7种短周期元素。
已知C与氢元素组成生活中最常见的化合物X。请填写下列空白。
(1)B元素周期表中的位置_______ ,与E同族下一周期元素的原子结构示意图为_______ 。
(2)A与氢元素组成含有10个电子的分子的化学式为_______ ;C与D组成的两种物质所含的化学键类型有_______ 。
(3)D的单质与X反应的离子方程式_______ ,G的单质与X反应的化学方程式_______ ,F元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式_______ 。
| A | B | C | ||||
| D | E | F | G |
(1)B元素周期表中的位置
(2)A与氢元素组成含有10个电子的分子的化学式为
(3)D的单质与X反应的离子方程式
您最近一年使用:0次
3 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)表中K元素在元素周期表中的位置为___________ 。
(2)基态Q原子的电子排布式为___________ 。基态Ⅰ原子简化电子排布式为___________ 。
(3)下列状态的F中,属于激发态原子的是___________(填标号)。
(4)基态 离子中未成对电子数为
离子中未成对电子数为___________ 。
(5)由C分别与P、B、G三种元素形成的二元化合物中,含离子键的是___________ (填化学式)。
(6)A和H的最高价氧化物对应的水化物酸性较强的是___________ (填化学式)。

(1)表中K元素在元素周期表中的位置为
(2)基态Q原子的电子排布式为
(3)下列状态的F中,属于激发态原子的是___________(填标号)。
A. | B. | C. | D.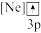 |
 离子中未成对电子数为
离子中未成对电子数为(5)由C分别与P、B、G三种元素形成的二元化合物中,含离子键的是
(6)A和H的最高价氧化物对应的水化物酸性较强的是
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近一年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:广东省东莞市东华中学2021-2022学年高一下学期第一次月考化学试题(B卷)
名校
解题方法
5 . 自然界中存在一种天然硅铝酸盐,它们具有筛选分子、吸附、离子交换和催化作用。这种天然物质称为沸石,人工合成的沸石也被称为分子筛。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.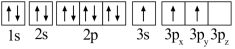 B.
B.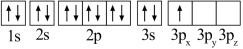
C.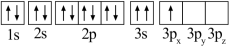 D.
D.
其中能量最低的是_____ (填字母),状态A中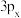 的电子云轮廓图为
的电子云轮廓图为_____ ,状态C电子排布图有错误,主要不符合_____ 。
(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为_____ (填字母),该化合物阴离子的空间构型是___________ 。
A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为___________ ,0.5mol丙烯中含___________ mol 键。
键。
(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为___________ ,铝原子的半径为___________ nm(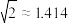 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
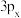 的电子云轮廓图为
的电子云轮廓图为(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在
 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为
 键。
键。(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为
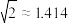 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
您最近一年使用:0次
2021-12-30更新
|
182次组卷
|
3卷引用:广东省汕头市第一中学2022届高三下学期4月月考化学试题
解题方法
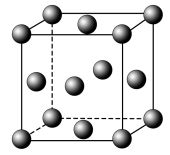
6 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)Ga原子的价电子排布式为___________ ;Ga、As和Se的第一电离能由小到大的顺序是___________ 。
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。
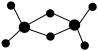
①该分子中Al原子采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有___________ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为___________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是___________ 。
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的___________ (填“正四面体形” 或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和As的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为___________ pm(列出表达式)。

(1)Ga原子的价电子排布式为
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
名校
7 . 合成氨及其相关工业中,部分物质间的转化关系如下图所示。
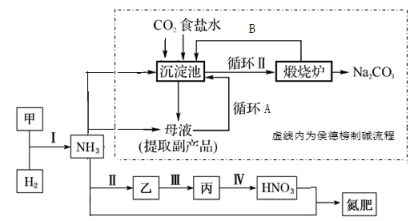
按要求回答下列问题:
(1) NH3的电子式是___________ 。
(2)在沉淀池发生的离子方程式为___________ 。
(3)母液提取副产品化学式为___________ 。
(4)煅烧炉发生的化学方程式为___________ 。
(5)写出步骤Ⅱ化学方程式___________ 。
(6)步骤Ⅳ尾气中 NO、NO2现用尿素[CO(NH2)2]处理为无害气体,若它们三者以物质的量之比 1∶1∶1 加热催化反应生成无害气体,则化学方程式为___________ 。
(7)氮及其化合物在催化剂 a 和催化剂 b 转化过程如图所示。下列分析合理的是___
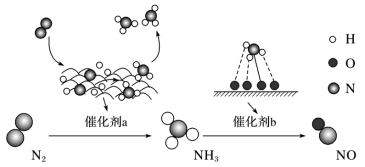
A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与 H2反应属于氮的固定过程
C.在催化剂 b 表面形成氮氧键时不涉及电子转移

按要求回答下列问题:
(1) NH3的电子式是
(2)在沉淀池发生的离子方程式为
(3)母液提取副产品化学式为
(4)煅烧炉发生的化学方程式为
(5)写出步骤Ⅱ化学方程式
(6)步骤Ⅳ尾气中 NO、NO2现用尿素[CO(NH2)2]处理为无害气体,若它们三者以物质的量之比 1∶1∶1 加热催化反应生成无害气体,则化学方程式为
(7)氮及其化合物在催化剂 a 和催化剂 b 转化过程如图所示。下列分析合理的是

A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与 H2反应属于氮的固定过程
C.在催化剂 b 表面形成氮氧键时不涉及电子转移
您最近一年使用:0次
2021-04-28更新
|
481次组卷
|
4卷引用:广东省茂名化州市第一中学2021-2022学年高一下学期期中考试化学试题
名校
8 . 几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
(1)R的元素符号为___ ,M在元素周期表中的位置为___ 。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___ ,所含化学键类型___ 。
(3)X+、Y2-、M2-离子半径大小顺序为___ 。
(4)将YM2通入FeCl3溶液中的离子方程式:___ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(2)X与Y按原子个数比1∶1构成的物质的电子式为
(3)X+、Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
您最近一年使用:0次
9 . 氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____ 方法区分晶体、准晶体和非晶体。
(2)基态锑(Sb)原子价电子排布的轨道式为____ 。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______ ,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是_______ 、_________ 。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序_____ (填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_____ 。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______ (填序号):
A.离子键 B.σ键 C.π键 D.配位键 E.范德华力
(4)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为NA,该晶体的密度ρ=____ g/cm3。

(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过
(2)基态锑(Sb)原子价电子排布的轨道式为
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在
A.离子键 B.σ键 C.π键 D.配位键 E.范德华力
(4)某砷镍合金的晶胞如图所示,设阿伏加 德罗常数的值为NA,该晶体的密度ρ=

您最近一年使用:0次
2019-12-05更新
|
205次组卷
|
3卷引用:广东省深圳、汕头、潮州、揭阳名校2021届高三12月联考化学试题



