1 . 几种主族元素在周期表中的位置如图
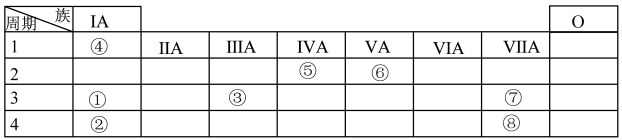
根据图表回答下列问题:
(1)⑥元素的氢化物的电子式是_______
(2)①③⑦三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是_______ ,其最高价氧化物对应的水化物所含的化学键有_______
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式);①与③最高价氧化物对应水化物反应的离子方程式为_______ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。

根据图表回答下列问题:
(1)⑥元素的氢化物的电子式是
(2)①③⑦三种元素原子半径由大到小的顺序是
(3)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是
(4)①②③三种元素最高价氧化物对应水化物碱性最强的是
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______(填字母)。
| A.⑦的氢化物比⑧的氢化物稳定 |
| B.⑦最高价氧化物对应的水化物的酸性强于⑧最高价氧化物对应的水化物的酸性 |
| C.⑦的单质能将⑧从其钠盐溶液中置换出来 |
| D.⑦的氢化物酸性比⑧的氢化物酸性弱 |
您最近半年使用:0次
名校
2 . 下表显示了元素周期表中短周期的一部分,A~G代表7种短周期元素。
已知C与氢元素组成生活中最常见的化合物X。请填写下列空白。
(1)B元素周期表中的位置_______ ,与E同族下一周期元素的原子结构示意图为_______ 。
(2)A与氢元素组成含有10个电子的分子的化学式为_______ ;C与D组成的两种物质所含的化学键类型有_______ 。
(3)D的单质与X反应的离子方程式_______ ,G的单质与X反应的化学方程式_______ ,F元素的最高价氧化物对应水化物与氢氧化钠反应的离子方程式_______ 。
| A | B | C | ||||
| D | E | F | G |
(1)B元素周期表中的位置
(2)A与氢元素组成含有10个电子的分子的化学式为
(3)D的单质与X反应的离子方程式
您最近半年使用:0次
3 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:

(1)表中K元素在元素周期表中的位置为___________ 。
(2)基态Q原子的电子排布式为___________ 。基态Ⅰ原子简化电子排布式为___________ 。
(3)下列状态的F中,属于激发态原子的是___________(填标号)。
(4)基态 离子中未成对电子数为
离子中未成对电子数为___________ 。
(5)由C分别与P、B、G三种元素形成的二元化合物中,含离子键的是___________ (填化学式)。
(6)A和H的最高价氧化物对应的水化物酸性较强的是___________ (填化学式)。

(1)表中K元素在元素周期表中的位置为
(2)基态Q原子的电子排布式为
(3)下列状态的F中,属于激发态原子的是___________(填标号)。
A. | B. | C. | D.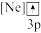 |
 离子中未成对电子数为
离子中未成对电子数为(5)由C分别与P、B、G三种元素形成的二元化合物中,含离子键的是
(6)A和H的最高价氧化物对应的水化物酸性较强的是
您最近半年使用:0次
4 . 下表为元素周期表的一部分,请回答有关问题:
(1)元素⑨的原子结构示意图为___________ 。已知元素⑨的一种核素,其中子数为45,用原子符号表示该核素为___________ 。
(2)由元素②和④形成的三核直线形分子的结构式为___________ 。
(3)由元素④和⑤形成的淡黄色固体的电子式为___________ 。该物质所含的化学键有___________ 。
(4)元素⑥、⑦、⑧的离子半径由大到小的顺序是___________ (用离子符号表示);
(5)能比较元素非金属性强弱的实验事实是___________ (填字母序号)。
a.⑥的氢化物的酸性比⑦的氢化物的酸性弱
b.⑦的单质比⑥的单质更容易与 化合,且生成的氢化物更稳定
化合,且生成的氢化物更稳定
c.在⑥的氢化物 的水溶液中通少量⑦的单质
的水溶液中通少量⑦的单质 气体可置换出单质
气体可置换出单质
d.④的简单氢化物的沸点比⑥的氢化物沸点高
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||
| 4 | ⑧ | ⑨ |
(2)由元素②和④形成的三核直线形分子的结构式为
(3)由元素④和⑤形成的淡黄色固体的电子式为
(4)元素⑥、⑦、⑧的离子半径由大到小的顺序是
(5)能比较元素非金属性强弱的实验事实是
a.⑥的氢化物的酸性比⑦的氢化物的酸性弱
b.⑦的单质比⑥的单质更容易与
 化合,且生成的氢化物更稳定
化合,且生成的氢化物更稳定c.在⑥的氢化物
 的水溶液中通少量⑦的单质
的水溶液中通少量⑦的单质 气体可置换出单质
气体可置换出单质
d.④的简单氢化物的沸点比⑥的氢化物沸点高
您最近半年使用:0次
名校
解题方法
5 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近半年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:广东省东莞市东华中学2021-2022学年高一下学期第一次月考化学试题(B卷)
名校
解题方法
6 . 自然界中存在一种天然硅铝酸盐,它们具有筛选分子、吸附、离子交换和催化作用。这种天然物质称为沸石,人工合成的沸石也被称为分子筛。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.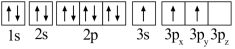 B.
B.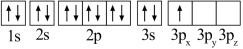
C.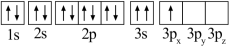 D.
D.
其中能量最低的是_____ (填字母),状态A中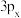 的电子云轮廓图为
的电子云轮廓图为_____ ,状态C电子排布图有错误,主要不符合_____ 。
(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为_____ (填字母),该化合物阴离子的空间构型是___________ 。
A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为___________ ,0.5mol丙烯中含___________ mol 键。
键。
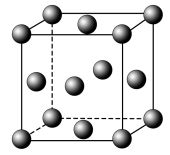
(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为___________ ,铝原子的半径为___________ nm(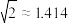 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
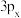 的电子云轮廓图为
的电子云轮廓图为(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在
 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为
 键。
键。(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为
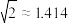 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
您最近半年使用:0次
2021-12-30更新
|
182次组卷
|
3卷引用:广东省汕头市第一中学2022届高三下学期4月月考化学试题
解题方法
7 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)Ga原子的价电子排布式为___________ ;Ga、As和Se的第一电离能由小到大的顺序是___________ 。
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。
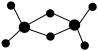
①该分子中Al原子采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有___________ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为___________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是___________ 。
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的___________ (填“正四面体形” 或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和As的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为___________ pm(列出表达式)。

(1)Ga原子的价电子排布式为
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近半年使用:0次
名校
8 . 合成氨及其相关工业中,部分物质间的转化关系如下图所示。
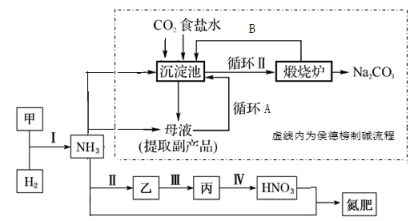
按要求回答下列问题:
(1) NH3的电子式是___________ 。
(2)在沉淀池发生的离子方程式为___________ 。
(3)母液提取副产品化学式为___________ 。
(4)煅烧炉发生的化学方程式为___________ 。
(5)写出步骤Ⅱ化学方程式___________ 。
(6)步骤Ⅳ尾气中 NO、NO2现用尿素[CO(NH2)2]处理为无害气体,若它们三者以物质的量之比 1∶1∶1 加热催化反应生成无害气体,则化学方程式为___________ 。
(7)氮及其化合物在催化剂 a 和催化剂 b 转化过程如图所示。下列分析合理的是___
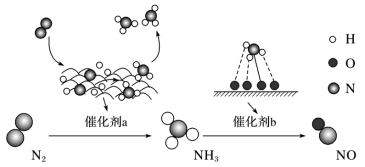
A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与 H2反应属于氮的固定过程
C.在催化剂 b 表面形成氮氧键时不涉及电子转移

按要求回答下列问题:
(1) NH3的电子式是
(2)在沉淀池发生的离子方程式为
(3)母液提取副产品化学式为
(4)煅烧炉发生的化学方程式为
(5)写出步骤Ⅱ化学方程式
(6)步骤Ⅳ尾气中 NO、NO2现用尿素[CO(NH2)2]处理为无害气体,若它们三者以物质的量之比 1∶1∶1 加热催化反应生成无害气体,则化学方程式为
(7)氮及其化合物在催化剂 a 和催化剂 b 转化过程如图所示。下列分析合理的是

A.催化剂 a 表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与 H2反应属于氮的固定过程
C.在催化剂 b 表面形成氮氧键时不涉及电子转移
您最近半年使用:0次
2021-04-28更新
|
469次组卷
|
4卷引用:广东省茂名化州市第一中学2021-2022学年高一下学期期中考试化学试题
名校
9 . 几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
(1)R的元素符号为___ ,M在元素周期表中的位置为___ 。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___ ,所含化学键类型___ 。
(3)X+、Y2-、M2-离子半径大小顺序为___ 。
(4)将YM2通入FeCl3溶液中的离子方程式:___ 。
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(2)X与Y按原子个数比1∶1构成的物质的电子式为
(3)X+、Y2-、M2-离子半径大小顺序为
(4)将YM2通入FeCl3溶液中的离子方程式:
您最近半年使用:0次
解题方法
10 . 下表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
(1)这10种元素中,化学性质最不活泼的元素是________ (填元素符号),非金属性最强的元素是________ (填元素符号)。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是________ 。
(3)①②③三种元素的原子半径由大到小的顺序是________ (填元素符号)。
(4)某元素的最高价氧化物对应的水化物既能与酸又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是________ 。
(5)下列物质中:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦ NH4Cl ⑧ H2O2既含有极性键又含有非极性键的是________ ;(填序号)
(6)晶体中阳离子阴离子个数比为2:1的有________ (填序号)
(7)含有配位键的是________ (填序号)
(8)非极性分子有________ (填序号)
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)这10种元素中,化学性质最不活泼的元素是
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是
(4)某元素的最高价氧化物对应的水化物既能与酸又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是
(5)下列物质中:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦ NH4Cl ⑧ H2O2既含有极性键又含有非极性键的是
(6)晶体中阳离子阴离子个数比为2:1的有
(7)含有配位键的是
(8)非极性分子有
您最近半年使用:0次



