名校
解题方法
1 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)CuCl的盐酸溶液能够与CO发生反应: 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有___________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2) 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为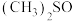 。
。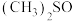 中C—S—O的键角
中C—S—O的键角___________ (填“大于”“小于”或“等于”) 中C—C—O的键角,理由是
中C—C—O的键角,理由是___________ ;元素S、Cl、O的电负性由大到小的顺序为___________ 。
(3) 溶液与乙二胺(
溶液与乙二胺(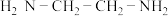 )可形成配离子
)可形成配离子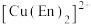 (En是乙二胺的简写):
(En是乙二胺的简写):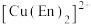 的配位原子为
的配位原子为___________ 。
②乙二胺分子中氮原子轨道的杂化类型为___________ ,乙二胺和三甲胺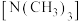 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___________ 。
(1)CuCl的盐酸溶液能够与CO发生反应:
 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2)
 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为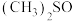 。
。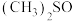 中C—S—O的键角
中C—S—O的键角 中C—C—O的键角,理由是
中C—C—O的键角,理由是(3)
 溶液与乙二胺(
溶液与乙二胺(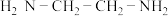 )可形成配离子
)可形成配离子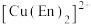 (En是乙二胺的简写):
(En是乙二胺的简写):
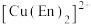 的配位原子为
的配位原子为②乙二胺分子中氮原子轨道的杂化类型为
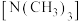 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
您最近一年使用:0次
2 . 已知 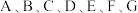 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和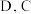 和
和  为同一主族元素,A与
为同一主族元素,A与 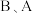 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是_____________ ,画出其原子结构示意图:_________________ .
(2)元素 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为_____________________________ 。
(3)元素B的最低价氢化物的电子式为_____________________ 。
(4)由 所形成的常见离子化合物是
所形成的常见离子化合物是_____________ (写化学式),其所含化学键类型为_____________ 。
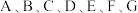 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和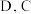 和
和  为同一主族元素,A与
为同一主族元素,A与 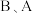 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:(1)七种元素中,非金属性最强的元素在周期表中的位置是
(2)元素
 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为(3)元素B的最低价氢化物的电子式为
(4)由
 所形成的常见离子化合物是
所形成的常见离子化合物是
您最近一年使用:0次
3 . 元素X、Y、Z、M、N、R均为短周期主族元素,且原子序数依次增大。X与Y可形成原子个数比为 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
(1)R在元素周期表中的位置为___________ 。
(2)R、Z、M、N的简单离子半径由大到小的顺序为___________ 。(填离子符号)。
(3)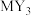 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为___________ 。
(4)M、N的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)A能与B反应生成无毒气体,该反应的化学方程式为___________ 。
 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:(1)R在元素周期表中的位置为
(2)R、Z、M、N的简单离子半径由大到小的顺序为
(3)
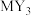 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为(4)M、N的最高价氧化物对应的水化物反应的离子方程式为
(5)A能与B反应生成无毒气体,该反应的化学方程式为
您最近一年使用:0次
4 . 如图所示为元素周期表的一部分,表中每个字母分别代表一种元素。
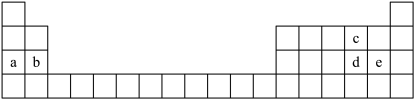
回答下列问题:
(1)d的阴离子的结构示意图为_______ 。
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为_______ 。
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序_______ (用化学式表示)。
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)
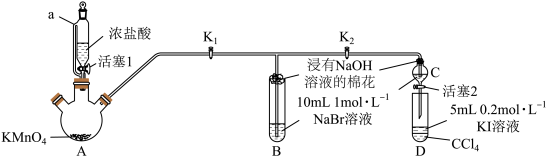
实验过程:
I.打开 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。
II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为_______ 。
②过程I,B、C中的溶液都变黄色的原因_______ (用离子方程式表示)。
③过程II的目的是_______ 。
④过程III的目的是验证溴的氧化性强于碘。简述操作过程_______ 。

回答下列问题:
(1)d的阴离子的结构示意图为
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)

实验过程:
I.打开
 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为
②过程I,B、C中的溶液都变黄色的原因
③过程II的目的是
④过程III的目的是验证溴的氧化性强于碘。简述操作过程
您最近一年使用:0次
解题方法
5 . 如图是元素周期表的一部分,表中的每个序号代表一种短周期元素,用相应的元素符号或化学式填空回答下列问题:
(1)元素①和③可以组成最简单的有机物,其化学式为____ 。
(2)元素⑤组成的两种常见的同素异形体是____ 。
(3)在这些元素中,化学性质最不活泼的元素是____ 。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是____ ,碱性最强的是____ ,呈两性的氢氧化物是____ 。
(5)元素⑦和⑩可组成阴、阳离子个数比为1:1的化合物,化学式为____ 。
(6)上述元素中,非金属性最强的是____ ,金属性最强的是____ 。
(7)元素④和⑦分别形成的最高价氧化物水化物之间发生反应生成的盐的化学键类型为____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | ||||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素⑤组成的两种常见的同素异形体是
(3)在这些元素中,化学性质最不活泼的元素是
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
(5)元素⑦和⑩可组成阴、阳离子个数比为1:1的化合物,化学式为
(6)上述元素中,非金属性最强的是
(7)元素④和⑦分别形成的最高价氧化物水化物之间发生反应生成的盐的化学键类型为
您最近一年使用:0次
解题方法
6 . 镓及其化合物在半导体领域有重要应用。回答下列问题:
(1)已知镓有两种同位素 和
和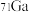 ,镓的平均相对原子质量为69.72,则
,镓的平均相对原子质量为69.72,则 和
和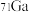 在自然界里的丰度之比为
在自然界里的丰度之比为_______ 。
(2)通常情况下, 的熔点为
的熔点为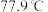 ,沸点为
,沸点为 ,其二聚物结构式为
,其二聚物结构式为_______ 。
(3)酞菁和氯代酞菁镓结构如图所示:

①酞菁分子中C的杂化方式为_______ 。
②镓位于元素周期表的_______ 区。
③氯代酞菁镓中含有的化学键有_______ (填序号)
A.氢键 B.配位键 C.非极性键 D.极性键
(4)某氧化镓晶体晶胞结构如图所示,其中 位于顶点、上下面心和内部,
位于顶点、上下面心和内部,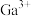 位置未标出。
位置未标出。

①该晶胞中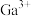 的个数为
的个数为_______ 。
②已知氧离子半径为anm,晶胞的高为bnm,该晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______ (用含a、b、 的代数式表示)。
的代数式表示)。
(1)已知镓有两种同位素
 和
和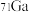 ,镓的平均相对原子质量为69.72,则
,镓的平均相对原子质量为69.72,则 和
和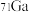 在自然界里的丰度之比为
在自然界里的丰度之比为(2)通常情况下,
 的熔点为
的熔点为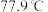 ,沸点为
,沸点为 ,其二聚物结构式为
,其二聚物结构式为(3)酞菁和氯代酞菁镓结构如图所示:

①酞菁分子中C的杂化方式为
②镓位于元素周期表的
③氯代酞菁镓中含有的化学键有
A.氢键 B.配位键 C.非极性键 D.极性键
(4)某氧化镓晶体晶胞结构如图所示,其中
 位于顶点、上下面心和内部,
位于顶点、上下面心和内部,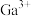 位置未标出。
位置未标出。
①该晶胞中
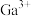 的个数为
的个数为②已知氧离子半径为anm,晶胞的高为bnm,该晶体的密度为
 ,则阿伏加德罗常数
,则阿伏加德罗常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7 . 1869年,俄国化学家门捷列夫制作了第一张元素周期表,下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
(1)元素b的一种核素可以测定文物年代,该核素是___________ (填化学符号),e在元素周期表中所在的位置是___________ 。
(2)a、c、d三种元素形成一种化合物的电子式为___________ ,该化合物含有的化学键类型___________ (填“离子键”、“极性键”、“非极性键”)。
(3)写出单质f与d的最高价氧化物对应水化物反应的离子反应方程式___________ 。
(4)元素g、h、i的最高价氧化物对应水化物的酸性由强到弱的顺序为___________ (用化学式表示)。
| a | |||||||||||||||||
| b | c | ||||||||||||||||
| d | e | f | g | h | i | ||||||||||||
| j |
(2)a、c、d三种元素形成一种化合物的电子式为
(3)写出单质f与d的最高价氧化物对应水化物反应的离子反应方程式
(4)元素g、h、i的最高价氧化物对应水化物的酸性由强到弱的顺序为
您最近一年使用:0次
解题方法
8 . 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表是5种短周期主族元素的相关信息。
回答下列问题:
(1)X在元素周期表中的位置为______ 。
(2)由Y与Z形成的一种化合物可作供氧剂,该化合物中所含化学键的类型为______ 。
(3)Y、Z、Q的简单离子半径由大到小的顺序为______ (用离子符号表示)。
(4)常温下,将W的单质通入Z的最高价氧化物的水化物的溶液中,可以得到消毒液,该反应的化学方程式为______ 。
(5)研究W、Q非金属性强弱的方案中不可行的是______ (填序号)。
a.比较其简单氢化物的沸点 b.比较其单质与氢气反应的难易程度
c.比较其简单阴离子的还原性 d.比较其氧化物的水化物的酸性
| 元素 | 信息 |
| X | 其中一种核素在考古时常用来测定文物的年代 |
| Y | 最外层电子数是次外层电子数的3倍 |
| Z | 短周期主族元素中,其原子半径最大 |
| W | 常温下,其单质是一种黄绿色的气体 |
| Q | 最高化合价与最低化合价的代数和为4 |
(1)X在元素周期表中的位置为
(2)由Y与Z形成的一种化合物可作供氧剂,该化合物中所含化学键的类型为
(3)Y、Z、Q的简单离子半径由大到小的顺序为
(4)常温下,将W的单质通入Z的最高价氧化物的水化物的溶液中,可以得到消毒液,该反应的化学方程式为
(5)研究W、Q非金属性强弱的方案中不可行的是
a.比较其简单氢化物的沸点 b.比较其单质与氢气反应的难易程度
c.比较其简单阴离子的还原性 d.比较其氧化物的水化物的酸性
您最近一年使用:0次
2021-02-02更新
|
292次组卷
|
2卷引用:山东省临沂市2020-2021学年高一上学期期末监测化学试题
解题方法
9 . 现有短周期元素的性质与原子(或分子)结构如表所示:
(1)元素N在周期表中的位置__________ ,其最高价氧化物的化学式是__________ 。
(2)T、X、Y三元素简单离子半径由大到小的顺序是__________ (用离子符号表示),元素M和N的最高价氧化物对应水化物的酸性由强到弱的顺序是__________ (用化学式表示),元素M和T的简单气态氢化物的稳定性由强到弱的顺序是__________ (用化学式表示)
(3)化合物Y2T2的电子式是__________ ,该化合物中存在的化学键类型有__________ 。
(4)元素Y、Z的最高价氧化物对应水化物反应的离子方程式是__________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | L层电子数是Y内层电子数的一半 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
| M | 最高正价与最低负价代数和为2 |
| N | 单质为黄绿色气体,它的一种盐是84消毒液的主要成分 |
(2)T、X、Y三元素简单离子半径由大到小的顺序是
(3)化合物Y2T2的电子式是
(4)元素Y、Z的最高价氧化物对应水化物反应的离子方程式是
您最近一年使用:0次
解题方法
10 . 盐酸阿比多尔是一种盐酸盐,其主要作用是通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制,结构如图。回答下列问题:
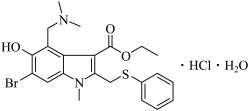
(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为___ 。O原子核外有___ 种不同运动状态的电子,基态S原子的价电子排布图不是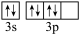 ,是因为该排布方式违背了
,是因为该排布方式违背了___ 。
(2)该结构中N原子的杂化方式是___ 。已知在氨分子中,H—N—H键角为107.3°,但是在[Zn(NH3)6]2+离子中H—N—H键角变为109.5°,分析原因为___ 。
(3)盐酸阿比多尔中不含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。
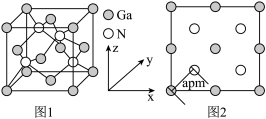
①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因____ 。
②晶胞中与一个Ga原子距离最近且相等的N原子有____ 个。
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是___ g·cm−3(列出计算表达式)。

(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)该结构中N原子的杂化方式是
(3)盐酸阿比多尔中不含有的化学键类型为
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。

①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因
②晶胞中与一个Ga原子距离最近且相等的N原子有
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是
您最近一年使用:0次



