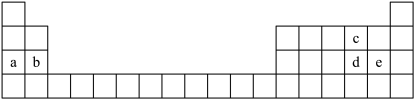
1 . 如图所示为元素周期表的一部分,表中每个字母分别代表一种元素。
回答下列问题:
(1)d的阴离子的结构示意图为_______ 。
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为_______ 。
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序_______ (用化学式表示)。
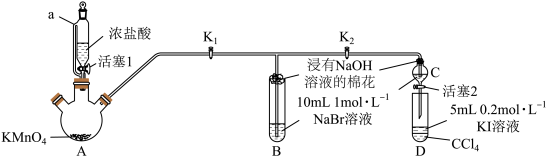
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)
实验过程:
I.打开 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。
II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为_______ 。
②过程I,B、C中的溶液都变黄色的原因_______ (用离子方程式表示)。
③过程II的目的是_______ 。
④过程III的目的是验证溴的氧化性强于碘。简述操作过程_______ 。

回答下列问题:
(1)d的阴离子的结构示意图为
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)

实验过程:
I.打开
 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为
②过程I,B、C中的溶液都变黄色的原因
③过程II的目的是
④过程III的目的是验证溴的氧化性强于碘。简述操作过程
您最近一年使用:0次
解题方法
2 . 如图是元素周期表的一部分,表中的每个序号代表一种短周期元素,用相应的元素符号或化学式填空回答下列问题:
(1)元素①和③可以组成最简单的有机物,其化学式为____ 。
(2)元素⑤组成的两种常见的同素异形体是____ 。
(3)在这些元素中,化学性质最不活泼的元素是____ 。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是____ ,碱性最强的是____ ,呈两性的氢氧化物是____ 。
(5)元素⑦和⑩可组成阴、阳离子个数比为1:1的化合物,化学式为____ 。
(6)上述元素中,非金属性最强的是____ ,金属性最强的是____ 。
(7)元素④和⑦分别形成的最高价氧化物水化物之间发生反应生成的盐的化学键类型为____ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | ||||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素⑤组成的两种常见的同素异形体是
(3)在这些元素中,化学性质最不活泼的元素是
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是
(5)元素⑦和⑩可组成阴、阳离子个数比为1:1的化合物,化学式为
(6)上述元素中,非金属性最强的是
(7)元素④和⑦分别形成的最高价氧化物水化物之间发生反应生成的盐的化学键类型为
您最近一年使用:0次
解题方法
3 . 现有短周期元素的性质与原子(或分子)结构如表所示:
(1)元素N在周期表中的位置__________ ,其最高价氧化物的化学式是__________ 。
(2)T、X、Y三元素简单离子半径由大到小的顺序是__________ (用离子符号表示),元素M和N的最高价氧化物对应水化物的酸性由强到弱的顺序是__________ (用化学式表示),元素M和T的简单气态氢化物的稳定性由强到弱的顺序是__________ (用化学式表示)
(3)化合物Y2T2的电子式是__________ ,该化合物中存在的化学键类型有__________ 。
(4)元素Y、Z的最高价氧化物对应水化物反应的离子方程式是__________ 。
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | L层电子数是Y内层电子数的一半 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
| M | 最高正价与最低负价代数和为2 |
| N | 单质为黄绿色气体,它的一种盐是84消毒液的主要成分 |
(2)T、X、Y三元素简单离子半径由大到小的顺序是
(3)化合物Y2T2的电子式是
(4)元素Y、Z的最高价氧化物对应水化物反应的离子方程式是
您最近一年使用:0次
解题方法
4 . 盐酸阿比多尔是一种盐酸盐,其主要作用是通过抑制流感病毒脂膜与宿主细胞的融合而阻断病毒的复制,结构如图。回答下列问题:
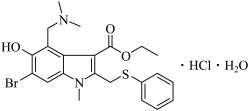
(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为___ 。O原子核外有___ 种不同运动状态的电子,基态S原子的价电子排布图不是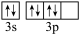 ,是因为该排布方式违背了
,是因为该排布方式违背了___ 。
(2)该结构中N原子的杂化方式是___ 。已知在氨分子中,H—N—H键角为107.3°,但是在[Zn(NH3)6]2+离子中H—N—H键角变为109.5°,分析原因为___ 。
(3)盐酸阿比多尔中不含有的化学键类型为___ (填选项字母)。
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。
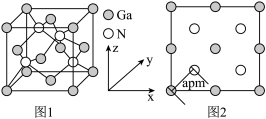
①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因____ 。
②晶胞中与一个Ga原子距离最近且相等的N原子有____ 个。
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是___ g·cm−3(列出计算表达式)。

(1)盐酸阿比多尔中所含N、O、S三种元素第一电离能由大到小的顺序为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)该结构中N原子的杂化方式是
(3)盐酸阿比多尔中不含有的化学键类型为
A.离子键 B.配位键 C.金属键 D.σ键 E.π键 F.极性键 G.非极性键
(4)以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。GaN晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图。

①氮化硼与氮化镓的结构类似,氮化硼熔点3000℃,氮化镓熔点1700℃,分析它们熔点不同的原因
②晶胞中与一个Ga原子距离最近且相等的N原子有
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是
您最近一年使用:0次
解题方法
5 . 我国采用的Cu2O/TiO2–NaBiO3光催化氧化技术能深度净化工业含有机物的废水。回答下列问题:
(1)钛(Ti)的基态原子M能层中能量不同的电子有_____________ 种。
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、 分子中O-H键的极性最强的是
分子中O-H键的极性最强的是_____________ 。
②C、N、O三种元素的电负性由大到小的顺序是_____________ 。
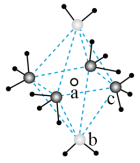
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为_____________ mol(包括配位键);向深蓝色溶液中缓慢加入乙醇,得到深蓝色晶体,加热该晶体先失去组分b的原因是_____________ 。
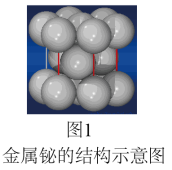
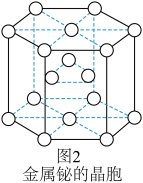
(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为_____________ g•cm-3 (用含r和NA数学表达式表示)。
(1)钛(Ti)的基态原子M能层中能量不同的电子有
(2)该技术能有效将含有机物废水中的农药、醇、油等降解为水、二氧化碳、硝酸根离子等小分子。
①H2O、CH3OH、
 分子中O-H键的极性最强的是
分子中O-H键的极性最强的是②C、N、O三种元素的电负性由大到小的顺序是
(3)将少量无水硫酸铜溶解在水中,形成蓝色溶液,再加入过量氨水,溶液变为深蓝色。深蓝色离子的结构如图所示,lmol该离子中所含σ键为

(4)铋合金具有凝固时不收缩的特性,用于铸造高精度铸型。金属铋的结构示意图如图1所示,其晶胞结构如图2所示。若铋原子的半径为rpm,则该晶体的密度为


您最近一年使用:0次
名校
解题方法
6 . 原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请回答下 列问题:
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:
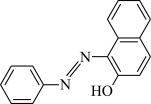
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:
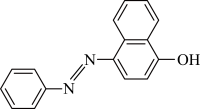
则其在水中的溶解度会_____ (填“增大”或“减小”),原因是_____ 。
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为_______ ,由 Cl-所形成的化学键类型是_______ 。
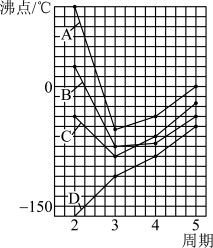
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是_____ ;表示ⅣA族元素氢化物沸点的曲线是_____ ;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是__________ ;A、B、C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是_______________ 。
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:

苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:

则其在水中的溶解度会
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是

您最近一年使用:0次
2020-04-06更新
|
162次组卷
|
3卷引用:山东省滕州市第一中学2019-2020学年高二下学期第二次月考化学试题
名校
7 . A、B、C、D、E、F 六种短周期主族元素,它们的原子序数依次增大。A 与 E 同主族,D 与 F 同主族,且 A 与 D 能形成两种液态化合物;B 的某种单质是自然界中硬度最大的物质,C 与D 形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F 在元素周期表中的位置是_____ ,D、E、F 三种元素简单离子半径由大到小的顺序是________ (用离子符号表示)。
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是_____ 。
(3)实验室可利用_____ (填试剂名称)清洗附着于试管内壁的 F 单质。
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为_____ 。
(1)F 在元素周期表中的位置是
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是
(3)实验室可利用
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___ (填元素符号)。
(2)b单质分子中σ键与π键的个数比为___ 。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___ ;这两种物质的互溶物中,存在的化学键有___ (填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___ (填化学式,下同);酸根呈正三角形结构的酸是___ ,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___ 酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___ 区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为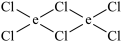 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键___ 。
回答下列问题:
(1)b、c、d电负性最大的是
(2)b单质分子中σ键与π键的个数比为
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是
(5)元素e在周期表中的位置是
 ,请补写e的元素符号并用“→”表示出其中的配位键
,请补写e的元素符号并用“→”表示出其中的配位键
您最近一年使用:0次
2019-12-02更新
|
527次组卷
|
4卷引用:山东省潍坊市2020届高三9月月考化学试题
山东省潍坊市2020届高三9月月考化学试题山东省潍坊市2019—2020学年高三上学期10月质量检测化学试题(已下线)易错点15 化学键-备战2023年高考化学考试易错题北京市十一学校2023-2024学年高三一模化学试题
解题方法
9 . A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置________ 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________ 。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______ 。检验该化合物中的阳离子的方法是________ (用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________ 。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________ 。
(1)元素F在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
388次组卷
|
3卷引用:2015届山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷



