名校
解题方法
1 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)CuCl的盐酸溶液能够与CO发生反应: 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有___________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2) 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为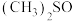 。
。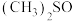 中C—S—O的键角
中C—S—O的键角___________ (填“大于”“小于”或“等于”) 中C—C—O的键角,理由是
中C—C—O的键角,理由是___________ ;元素S、Cl、O的电负性由大到小的顺序为___________ 。
(3) 溶液与乙二胺(
溶液与乙二胺(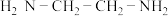 )可形成配离子
)可形成配离子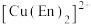 (En是乙二胺的简写):
(En是乙二胺的简写):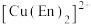 的配位原子为
的配位原子为___________ 。
②乙二胺分子中氮原子轨道的杂化类型为___________ ,乙二胺和三甲胺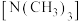 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___________ 。
(1)CuCl的盐酸溶液能够与CO发生反应:
 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2)
 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为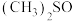 。
。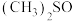 中C—S—O的键角
中C—S—O的键角 中C—C—O的键角,理由是
中C—C—O的键角,理由是(3)
 溶液与乙二胺(
溶液与乙二胺(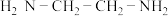 )可形成配离子
)可形成配离子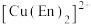 (En是乙二胺的简写):
(En是乙二胺的简写):
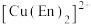 的配位原子为
的配位原子为②乙二胺分子中氮原子轨道的杂化类型为
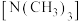 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
您最近一年使用:0次
2 . 已知 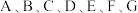 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和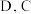 和
和  为同一主族元素,A与
为同一主族元素,A与 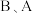 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是_____________ ,画出其原子结构示意图:_________________ .
(2)元素 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为_____________________________ 。
(3)元素B的最低价氢化物的电子式为_____________________ 。
(4)由 所形成的常见离子化合物是
所形成的常见离子化合物是_____________ (写化学式),其所含化学键类型为_____________ 。
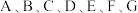 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和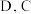 和
和  为同一主族元素,A与
为同一主族元素,A与 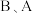 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:(1)七种元素中,非金属性最强的元素在周期表中的位置是
(2)元素
 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为(3)元素B的最低价氢化物的电子式为
(4)由
 所形成的常见离子化合物是
所形成的常见离子化合物是
您最近一年使用:0次
名校
3 . 元素X、Y、Z、M、N、R均为短周期主族元素,且原子序数依次增大。X与Y可形成原子个数比为 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
(1)R在元素周期表中的位置为___________ 。
(2)R、Z、M、N的简单离子半径由大到小的顺序为___________ 。(填离子符号)。
(3)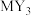 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为___________ 。
(4)M、N的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)A能与B反应生成无毒气体,该反应的化学方程式为___________ 。
 的18电子分子A,X与Z可形成原子个数比为
的18电子分子A,X与Z可形成原子个数比为 的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应,
的18电子分子B,M、N、R的最高价氧化物对应的水化物两两之间可以发生反应, 常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:
常用作漂白剂、防腐剂、抗氧化剂。回答下列问题:(1)R在元素周期表中的位置为
(2)R、Z、M、N的简单离子半径由大到小的顺序为
(3)
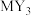 常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为
常用作汽车安全气囊的气体发生剂,该化合物中所含化学键的类型为(4)M、N的最高价氧化物对应的水化物反应的离子方程式为
(5)A能与B反应生成无毒气体,该反应的化学方程式为
您最近一年使用:0次
2023-07-12更新
|
303次组卷
|
3卷引用:山东省青岛39中(海大附中)2023-2024学年高一下学期6月阶段性检测化学试题
名校
解题方法
4 . 原子结构与元素周期表存在着内在联系。根据所学物质结构知识,请回答下 列问题:
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:
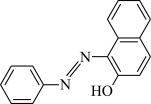
苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:
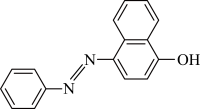
则其在水中的溶解度会_____ (填“增大”或“减小”),原因是_____ 。
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为_______ ,由 Cl-所形成的化学键类型是_______ 。
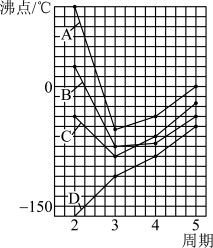
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是_____ ;表示ⅣA族元素氢化物沸点的曲线是_____ ;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是__________ ;A、B、C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是_______________ 。
(1)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严 重危害人们健康。苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4 种类型,苏丹红Ⅰ的分子结构如图所示:

苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成如图所示的结构:

则其在水中的溶解度会
(2)已知 Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为 TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入 AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为
(3)如图中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是

您最近一年使用:0次
2020-04-06更新
|
162次组卷
|
3卷引用:山东省滕州市第一中学2019-2020学年高二下学期第二次月考化学试题
名校
5 . A、B、C、D、E、F 六种短周期主族元素,它们的原子序数依次增大。A 与 E 同主族,D 与 F 同主族,且 A 与 D 能形成两种液态化合物;B 的某种单质是自然界中硬度最大的物质,C 与D 形成的化合物是大气常见污染物之一。请回答下列问题:
(1)F 在元素周期表中的位置是_____ ,D、E、F 三种元素简单离子半径由大到小的顺序是________ (用离子符号表示)。
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是_____ 。
(3)实验室可利用_____ (填试剂名称)清洗附着于试管内壁的 F 单质。
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为_____ 。
(1)F 在元素周期表中的位置是
(2)元素 E、F 可形成多原子化合物E2Fx(x ≥ 2)。该化合物中所含的化学键类型是
(3)实验室可利用
(4)处理含 BC−废水的方法之一是在微生物的作用下,BC−被 D 的单质氧化成 ABD−,同时生成C 的简单氢化物,该反应的离子方程式为
您最近一年使用:0次
6 . 下表列出了9种元素在元素周期表中的位置示意。
请回答下列问题:
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是_____
(2)画出元素⑧形成的简单离子的结构示意图_________________
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为_________
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是__________________
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是_______ (填化学式),写出元素⑥的单质与水反应的离子反应方程式___________________ ,写出一个能证明元素⑧比元素⑨非金属性强的反应事实的离子方程式__________
| 周期 | ⅠA 1 | 0 18 | ||||||
| 1 | ⅡA 2 | ⅢA 13 | ⅣA 14 | ⅤA 15 | ⅥA 16 | ⅦA 17 | ||
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ | |||||||
(1)考古工作者利用元素②的一种核素测定一些文物的年代,这种核素的符号是
(2)画出元素⑧形成的简单离子的结构示意图
(3)写出元素④和⑥的单质在加热条件下反应,所得产物的电子式为
(4)⑥元素的最高价氧化物对应的水化物含有的化学键是
(5)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最强的是
您最近一年使用:0次
2020-01-26更新
|
190次组卷
|
2卷引用:山东省济宁市第二中学2020-2021学年高一上学期第三次阶段检测化学试题
解题方法
7 . A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置________ 。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)________ 。
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有______ 。检验该化合物中的阳离子的方法是________ (用离子方程式表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:________________________ 。若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________ 。
(1)元素F在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:
您最近一年使用:0次
2016-12-09更新
|
393次组卷
|
3卷引用:2015届山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷



