名校
解题方法
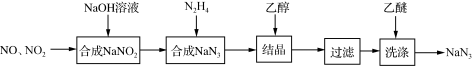
1 . 叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
您最近一年使用:0次
名校
解题方法
2 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)CuCl的盐酸溶液能够与CO发生反应: 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有___________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2) 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为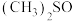 。
。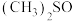 中C—S—O的键角
中C—S—O的键角___________ (填“大于”“小于”或“等于”) 中C—C—O的键角,理由是
中C—C—O的键角,理由是___________ ;元素S、Cl、O的电负性由大到小的顺序为___________ 。
(3) 溶液与乙二胺(
溶液与乙二胺(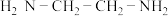 )可形成配离子
)可形成配离子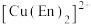 (En是乙二胺的简写):
(En是乙二胺的简写):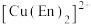 的配位原子为
的配位原子为___________ 。
②乙二胺分子中氮原子轨道的杂化类型为___________ ,乙二胺和三甲胺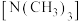 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___________ 。
(1)CuCl的盐酸溶液能够与CO发生反应:
 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2)
 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为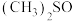 。
。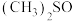 中C—S—O的键角
中C—S—O的键角 中C—C—O的键角,理由是
中C—C—O的键角,理由是(3)
 溶液与乙二胺(
溶液与乙二胺(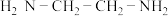 )可形成配离子
)可形成配离子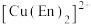 (En是乙二胺的简写):
(En是乙二胺的简写):
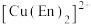 的配位原子为
的配位原子为②乙二胺分子中氮原子轨道的杂化类型为
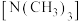 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
您最近一年使用:0次
3 . 已知 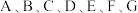 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和 和
和  为同一主族元素,A与
为同一主族元素,A与  与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:
(1)七种元素中,非金属性最强的元素在周期表中的位置是_____________ ,画出其原子结构示意图:_________________ .
(2)元素 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为_____________________________ 。
(3)元素B的最低价氢化物的电子式为_____________________ 。
(4)由 所形成的常见离子化合物是
所形成的常见离子化合物是_____________ (写化学式),其所含化学键类型为_____________ 。
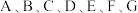 是原子序数依次递增的短周期元素,已知 A和
是原子序数依次递增的短周期元素,已知 A和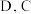 和
和  为同一主族元素,A与
为同一主族元素,A与 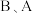 与
与  形成共价化合物,B原子的最外层电子数比次外层多3,
形成共价化合物,B原子的最外层电子数比次外层多3, 元素的最高正化合价与最低负化合价的代数和为6,
元素的最高正化合价与最低负化合价的代数和为6, 是同周期中离子半径最小的元素,
是同周期中离子半径最小的元素, 形成的化合物是造成酸雨的主要原因。请回答下列问题:
形成的化合物是造成酸雨的主要原因。请回答下列问题:(1)七种元素中,非金属性最强的元素在周期表中的位置是
(2)元素
 的简单离子的半径由小到大的顺序为
的简单离子的半径由小到大的顺序为(3)元素B的最低价氢化物的电子式为
(4)由
 所形成的常见离子化合物是
所形成的常见离子化合物是
您最近一年使用:0次
名校
解题方法
4 . 2008年北京奥运会的“水立方”,在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯 与四氟乙烯
与四氟乙烯 的共聚物
的共聚物 制成。
制成。
(1)2015年2月,科学家首次观测到化学键的形成。化学键不存在于_______。
(2)第三周期元素的原子中,未成对电子不可能有_______。
(3)基态F原子的轨道表示式为_______ ,四氟乙烯的电子式为_______ 。
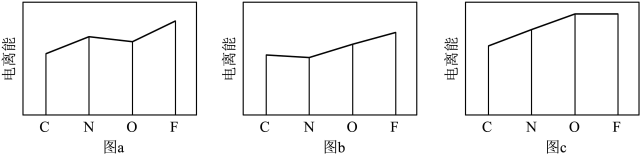
(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填字母),第三电离能的变化图是_______ (填字母)。
(5) 和
和 分子中C的杂化轨道类型分别为
分子中C的杂化轨道类型分别为_______ 和_______ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因_______ 。
(6)比较甲醚和乙醇的沸点高低,并说明理由_______ 。
 与四氟乙烯
与四氟乙烯 的共聚物
的共聚物 制成。
制成。(1)2015年2月,科学家首次观测到化学键的形成。化学键不存在于_______。
| A.原子与原子之间 | B.分子与分子之间 | C.离子与离子之间 | D.离子与电子之间 |
(2)第三周期元素的原子中,未成对电子不可能有_______。
| A.4个 | B.3个 | C.2个 | D.1个 |
(3)基态F原子的轨道表示式为
(4)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(5)
 和
和 分子中C的杂化轨道类型分别为
分子中C的杂化轨道类型分别为(6)比较甲醚和乙醇的沸点高低,并说明理由
您最近一年使用:0次
5 . 以粗盐和石英砂为原料制备纯碱和精硅的流程如下图所示,结合题意回答下列问题:
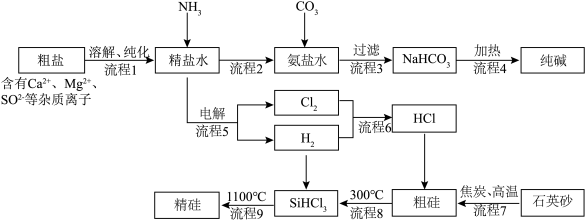
(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为________________ 。
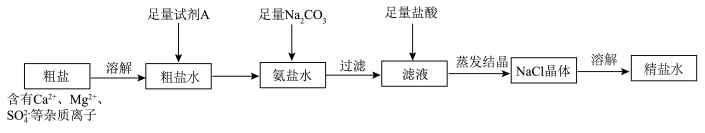
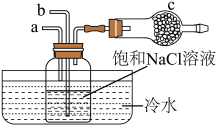
(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入________________ 气体,c装置固体为________________ 。
(3)流程4生成的Na2CO3,其含有的化学键为________________ 。
(4)流程7的化学方程式________________ 。
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是________________ 。
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。
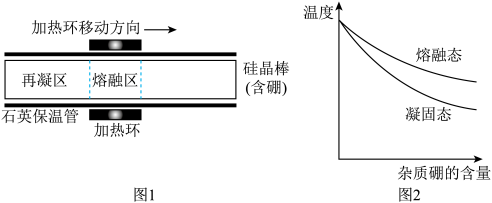
下列说法中错误的是________________。

(1)流程1可在实验室完成,过程如下图所示,若只加一种试剂,则A化学式为

(2)流程2和流程3也可在实验室模拟完成,具体过程如图所示,则a口通入

(3)流程4生成的Na2CO3,其含有的化学键为
(4)流程7的化学方程式
(5)流程9整个制备过程必须严格控制无氧,若混入O2,可能引起的后果是
(6)制得的精硅含有微量硼,会影响芯片性能。某实验室利用区域熔炼技术制高纯硅的装置剖面图如图1,将含微量杂质硼的硅晶棒装入石英保温管中,利用加热环自左向右缓慢移动对其进行加热熔炼,已知杂质硼在不同状态的硅中含量分布如图2所示。

下列说法中错误的是________________。
| A.混有杂质硼的硅晶棒熔点低于纯硅 |
| B.熔炼前,可以用普通玻璃管替换石英保温管 |
| C.熔炼时,加热环移动速度过快可能导致杂质硼分离不彻底 |
| D.熔炼后,硅晶棒纯度右端高于左端 |
您最近一年使用:0次
名校
6 . 下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:

(1)元素⑩在周期表中的位置是___________ ,⑦原子结构示意图为___________ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为___________ (用离子符号和“>”表示)。
(3)④⑧⑨的气态氢化物中,最稳定的是___________ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是___________ (用化学式表示)。
(4)由①③⑨组成的盐化学式为___________ ,其中含有的化学键类型是___________ 。

(1)元素⑩在周期表中的位置是
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)④⑧⑨的气态氢化物中,最稳定的是
(4)由①③⑨组成的盐化学式为
您最近一年使用:0次
7 . 20世纪初,科学家们先后开发、研究并实现了氨的工业生产。
(1)将 和
和 的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后三个容器的反应速率分别为
的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后三个容器的反应速率分别为 、
、 、
、 ,这段时间内三个容器中合成氨的反应速率的大小关系为___________。
,这段时间内三个容器中合成氨的反应速率的大小关系为___________。
(2)某压强下工业合成氨生产过程中, 与
与 按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。

①图甲中表示该反应已平衡的曲线是___________ (填“Ⅰ”或“Ⅱ”);由图甲中曲线变化趋势可推知工业合成氨的反应是___________ (填“吸热”或“放热”)反应。
②图甲中a点,容器内气体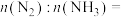
___________ ,图甲中b点,v(正)___________ v(逆)(填“>”“=”或“<”)。
(3)工业合成氨反应过程中的能量变化如图所示。

①合成氨反应中,断裂的化学键是___________ (填“离子键”或“共价键”)。
②生成17g 时,该反应
时,该反应___________ (填“吸收”或“放出”)的能量为___________ kJ。
(1)将
 和
和 的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后三个容器的反应速率分别为
的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后三个容器的反应速率分别为 、
、 、
、 ,这段时间内三个容器中合成氨的反应速率的大小关系为___________。
,这段时间内三个容器中合成氨的反应速率的大小关系为___________。A.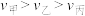 | B.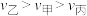 | C. | D.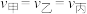 |
 与
与 按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
按体积比为1∶3投料时,反应混合物中氨的体积分数随温度的变化曲线如图甲所示,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
①图甲中表示该反应已平衡的曲线是
②图甲中a点,容器内气体
(3)工业合成氨反应过程中的能量变化如图所示。

①合成氨反应中,断裂的化学键是
②生成17g
 时,该反应
时,该反应
您最近一年使用:0次
名校
解题方法
8 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载,锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外的最高能层符号是___________ 。
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有___________ (填编号),乳酸锌中C原子的杂化方式有___________ 。
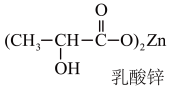
A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
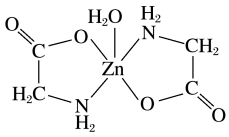
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是___________ , 的配位数为
的配位数为___________ ;甘氨酸易溶于水,试从结构角度解释___________ 。
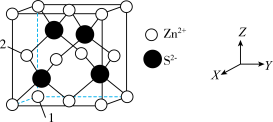
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。
②已知晶胞参数为apm,阿伏伽德罗常数为 ,求该晶胞的密度
,求该晶胞的密度
___________  (写计算表达式)。
(写计算表达式)。
(1)基态Zn原子核外的最高能层符号是
(2)乳酸锌(如图)是一种很好的食品锌强化剂,其中存在的作用力有

A离子键 B.极性共价键 C.金属键 D.配位键 E.范德华力
(3)一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示。其中所涉及的非金属元素的电负性由大到小的顺序是
 的配位数为
的配位数为
(4)Zn与S形成某种化合物的晶胞如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图中原子1的坐标为(0,0,0),则原子2的坐标为
②已知晶胞参数为apm,阿伏伽德罗常数为
 ,求该晶胞的密度
,求该晶胞的密度
 (写计算表达式)。
(写计算表达式)。
您最近一年使用:0次
名校
9 . I、吡啶(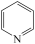 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
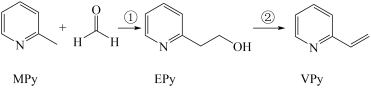
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为_______
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂_______ 个π键,形成_______ 个σ键。
(4)吡啶、 与
与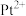 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
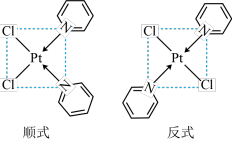
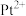 的配位数为
的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水_______ (填“能”或“否”),
Ⅱ、有下列实验:
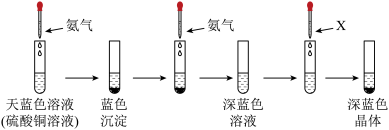
(5)该深蓝色晶体的化学式为_______ ,溶剂X可以是_______ (填名称),继续添加氨水,沉淀溶解,写出沉淀溶解的离子方程式为_______ 。
(6)该实验能说明 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是_______ 。
(7)下列有关化学实验“操作→现象→解释”均正确的是_______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为
(2)EPy晶体中微粒间的作用力类型有
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂
(4)吡啶、
 与
与 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
 的配位数为
的配位数为Ⅱ、有下列实验:

(5)该深蓝色晶体的化学式为
(6)该实验能说明
 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是(7)下列有关化学实验“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 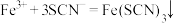 |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知 的配位数为6.则CrCl3·6H2O的化学式可表示为 的配位数为6.则CrCl3·6H2O的化学式可表示为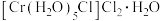 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加l0滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在: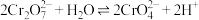 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近一年使用:0次
名校
解题方法
10 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮及氯物质的价类二维图如下,回答下列问题:
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:_______ 为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成_______ mol O2。
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:_______ 。
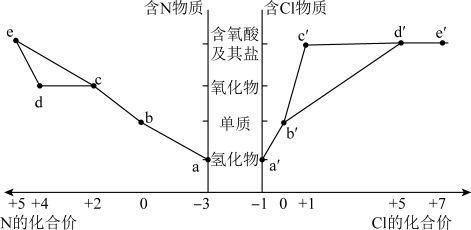
| A.a和c可在一定条件下反应生成b |
| B.工业上通过a→b→d→e来制备HNO3 |
C.浓的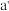 溶液和浓的 溶液和浓的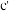 溶液反应可以得到 溶液反应可以得到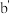 |
D.a和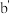 可在一定条件下反应生成b 可在一定条件下反应生成b |
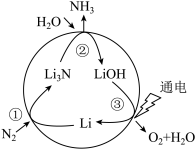
b.参与该人工固氮转化的物质中含有的化学键类型有
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
您最近一年使用:0次
2023-04-07更新
|
255次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高一下学期4月月考化学试题



