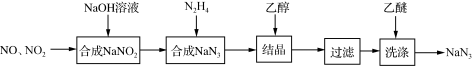
叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
更新时间:2024-04-15 09:14:30
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
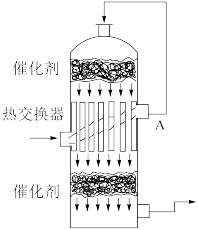
【推荐1】I.接触法制硫酸是先把 催化氧化成
催化氧化成 ,然后用浓硫酸吸收得到的
,然后用浓硫酸吸收得到的 制取产品。
制取产品。
(1)若将2mol 、1mol
、1mol 充入一密闭容器内充分反应后,放出热量98.3kJ,此时测得
充入一密闭容器内充分反应后,放出热量98.3kJ,此时测得 的转化率为50%,则反应的热化学方程式是
的转化率为50%,则反应的热化学方程式是_______ 。
(2)某工厂生产硫酸时,进入接触室的原料气成分为 7%、
7%、 11%、
11%、 82%(体积分数)。
82%(体积分数)。
则从接触室A出口出来的气体成分为_______ (写化学式);标准状况下 原料气中的
原料气中的 物质的量
物质的量_______ mol(结果保留两位小数)。
(3)计算标准状况下 原料气的质量是
原料气的质量是_______ kg(结果保留两位小数)。
II.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(4)工业上利用 和
和 可以合成
可以合成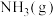 ,
,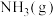 又可以进一步制备肼(
又可以进一步制备肼( )等。已知几种物质中化学键的键能如下表所示。
)等。已知几种物质中化学键的键能如下表所示。
写出合成氨的热化学方程式_______ 。
(5)在某温度下,若 和
和 的反应达到平衡时,各物质的平衡浓度为:
的反应达到平衡时,各物质的平衡浓度为: ,
,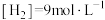 ,
, ,则起始浓度
,则起始浓度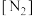
_______  ,
, 的转化率为
的转化率为_______ (结果保留到0.01)。
 催化氧化成
催化氧化成 ,然后用浓硫酸吸收得到的
,然后用浓硫酸吸收得到的 制取产品。
制取产品。
(1)若将2mol
 、1mol
、1mol 充入一密闭容器内充分反应后,放出热量98.3kJ,此时测得
充入一密闭容器内充分反应后,放出热量98.3kJ,此时测得 的转化率为50%,则反应的热化学方程式是
的转化率为50%,则反应的热化学方程式是(2)某工厂生产硫酸时,进入接触室的原料气成分为
 7%、
7%、 11%、
11%、 82%(体积分数)。
82%(体积分数)。则从接触室A出口出来的气体成分为
 原料气中的
原料气中的 物质的量
物质的量(3)计算标准状况下
 原料气的质量是
原料气的质量是II.氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(4)工业上利用
 和
和 可以合成
可以合成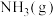 ,
,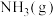 又可以进一步制备肼(
又可以进一步制备肼( )等。已知几种物质中化学键的键能如下表所示。
)等。已知几种物质中化学键的键能如下表所示。| 化学键 | H—H | N—H | N≡N |
键能( ) ) | 436 | 391 | 945 |
写出合成氨的热化学方程式
(5)在某温度下,若
 和
和 的反应达到平衡时,各物质的平衡浓度为:
的反应达到平衡时,各物质的平衡浓度为: ,
,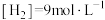 ,
, ,则起始浓度
,则起始浓度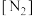
 ,
, 的转化率为
的转化率为
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】某厂为了测定一批Cu-Mg样品中铜的质量分数,取用10g样品,把200g稀盐酸分4次加入样品中(样品中除Cu-Mg外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如表:
(1)该样品中铜的质量分数是___ 。
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)___ 。
| 稀盐酸的用量 | 第一次加入50g | 第二次加入50g | 第三次加入50g | 第四次加入50g |
| 剩余固体的质量 | 8.8g | 7.6g | 6.4g | 6.4g |
(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】如图为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题
(1)①、②、③、④分别是_______ 、_______ 、_______ 、_______ (用元素符号表示)。
(2)画出⑤的原子结构示意图:_______ 。
(3)画出与⑧同族的下一周期元素的原子结构示意图:_______ 。
(4)⑥的单质与氢氧化钠溶液反应的化学方程式:_______ 。
(5)向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,产生H2(标况下)的体积为_______ L,参加反应的NaOH溶液的物质的量浓度为_______ mol/L。(忽略反应前后溶液体积的变化)。
(6)写出①的三种核素:_______ 、_______ 、_______ 。
(7)①、③、④元素中的两种元素可形成10个电子的分子,它们是_______ 、_______ 。(写出两个)
| 周期 | IA | 0 | |||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | …… | ② | ③ | ④ | |||||
| 3 | ⑤ | …… | ⑥ | ⑦ | ⑧ | ||||
(2)画出⑤的原子结构示意图:
(3)画出与⑧同族的下一周期元素的原子结构示意图:
(4)⑥的单质与氢氧化钠溶液反应的化学方程式:
(5)向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,产生H2(标况下)的体积为
(6)写出①的三种核素:
(7)①、③、④元素中的两种元素可形成10个电子的分子,它们是
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
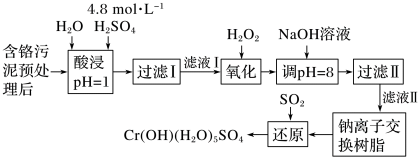
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 、_______ 。(答出两点)
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】通过“价类二维图”研究物质性质是化学研究的重要方法,如图是氯元素的部分化合价与物质类别的对应关系。
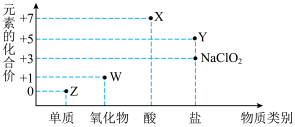
请回答:
(1)X化学式为______ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:16,则m:n=______ 。
(3)NaClO2与Z都可用于消毒,等物质的量的两种物质,消毒效率NaClO2是Z的______ 倍(消毒效率以单位物质的量得到的电子数表示)。我国最近成功研制出由NaClO2与Z制取ClO2的新方法,请写出该反应的化学方程式________ 。
(4)Y可用于实验室制取O2,其焰色试验为紫色,则Y的化学式是______ 。用Y和浓盐酸反应可制取Z气体,验证Z气体已经收集满的实验操作和现象是_______ 。

请回答:
(1)X化学式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:16,则m:n=
(3)NaClO2与Z都可用于消毒,等物质的量的两种物质,消毒效率NaClO2是Z的
(4)Y可用于实验室制取O2,其焰色试验为紫色,则Y的化学式是
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:
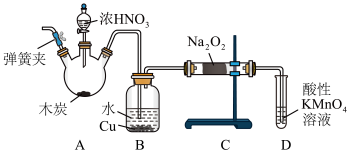
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是___ 。
(2)B中观察到的主要现象是___ ;
(3)A装置中反应的化学方程式为___ ;
(4)D装置中反应的离子方程式___ ;
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和___ 。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为___ 。
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭___ g。

已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间气体Ar,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡。上述操作的作用是
(2)B中观察到的主要现象是
(3)A装置中反应的化学方程式为
(4)D装置中反应的离子方程式
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和
(6)利用改进后的装置,将3.12gNa2O2完全转化成为NaNO2,理论上至少需要木炭
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐1】已知A、B、C、D是短周期元素的气态单质,其中A是黄绿色的气体单质,C在空气中含量最高,D是最轻的气体;E是一种最常用的金属;Y是一种常见的液态物质,Z是唯一显碱性的气体; M是一种红棕色的有毒气体;I为红褐色难溶于水的固体。有关的转化关系如下图所示(反应条件均已略去)。
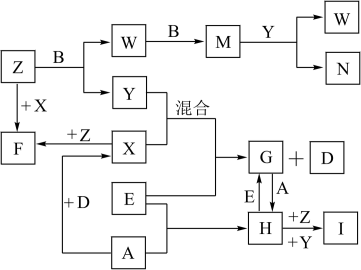
回答下列问题:
(1)A的组成元素在元素周期表的位置为____ ;
(2)F中化学键的类型是___ 、____ ;
(3)Z和W在催化剂作用下反应生成C和Y,这是很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为_ ;
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为____ g。

回答下列问题:
(1)A的组成元素在元素周期表的位置为
(2)F中化学键的类型是
(3)Z和W在催化剂作用下反应生成C和Y,这是很有实际意义的反应,可以消除W对环境的污染,该反应的化学方程式为
(4)将过量的E加到N的稀溶液中,若过程中转移电子的数目为3.01×1023,则参加反应的E的质量为
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】1869年门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系。元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是现代长式元素周期表的一部分,数字①~⑩代表十种元素,请按题目要求回答下列问题(以下问题均用相应的化学符号 表达):

(1)元素周期表中元素种类最多的族是_______ 。
(2)元素⑤的一种核素可以用来考古断代,该核素的符号为_______ 。画出元素⑩所形成简单离子的结构示意图:_______ 。
(3)在这10种元素中,原子半径最小的元素是_______ ;金属性最强的元素对应的单质与水反应的化学方程式为_______ 。
(4)元素③④⑦⑩的简单离子半径的由大到小的顺序为_______ ;比较元素⑨⑩的简单氢化物的还原性:_______ >_______ 。
(5)元素②的最高价氧化物对应的水化物的电子式为_______ ,其与元素⑧的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(6)由元素①⑥⑩三种元素形成的盐中所含化学键的类型有_______ 。

(1)元素周期表中元素种类最多的族是
(2)元素⑤的一种核素可以用来考古断代,该核素的符号为
(3)在这10种元素中,原子半径最小的元素是
(4)元素③④⑦⑩的简单离子半径的由大到小的顺序为
(5)元素②的最高价氧化物对应的水化物的电子式为
(6)由元素①⑥⑩三种元素形成的盐中所含化学键的类型有
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图所示的转化关系(反应条件略去)。
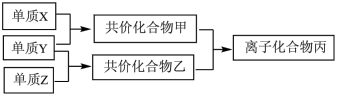
已知:a.常见双原子单质分子中,X分子所含共价键最多。
b.甲分子中含有10个电子,乙分子中含有18个电子。
(1)写出X的化学式_________________________________________ 。
(2)化合物丙中含有化学键的类型为__________________________________________ 。
(3)写出甲与乙反应生成丙的化学方程式___________________________________________________ 。

已知:a.常见双原子单质分子中,X分子所含共价键最多。
b.甲分子中含有10个电子,乙分子中含有18个电子。
(1)写出X的化学式
(2)化合物丙中含有化学键的类型为
(3)写出甲与乙反应生成丙的化学方程式
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据下图所示的仪器和所盛试剂填空:
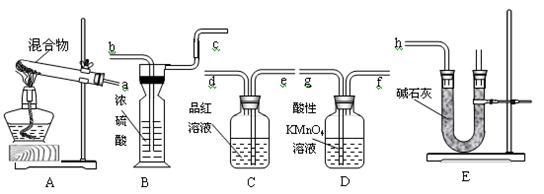
(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为____________________ 。
(2)仪器B的名称为_________ ,E装置中放碱石灰的仪器名称为________ ,A和E装置中都用到的仪器名称为__________ 。
(3)D的作用是_______________________________________________________ 。
(4)C的作用是_________________________________ ;若C瓶中溶液颜色有变化,则测定结果可能会偏__________ 。
(5)B的作用是_____________________________________ 。

(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为
(2)仪器B的名称为
(3)D的作用是
(4)C的作用是
(5)B的作用是
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液

(1)实验开始时稀硫酸应放在____ 中(填写仪器的序号“1”“2”或“3”)。
(2)本实验开始后,首先应排尽装置中的空气,其操作是_______________
(3)反应一段时间后,可通过控制A、B、C三个开关,将仪器2中的溶液自动转移至仪器3中,操作是_________
(4)实验时为防止仪器2中铁屑通过导管进入仪器3中,可采取的措施是_________________

(1)实验开始时稀硫酸应放在
(2)本实验开始后,首先应排尽装置中的空气,其操作是
(3)反应一段时间后,可通过控制A、B、C三个开关,将仪器2中的溶液自动转移至仪器3中,操作是
(4)实验时为防止仪器2中铁屑通过导管进入仪器3中,可采取的措施是
您最近半年使用:0次
【推荐3】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
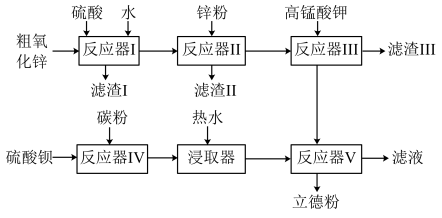
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___ 。
(2)加入锌粉的主要目的是___ (用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___ ;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____ 。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__ ;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__ 。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___ ,反应的化学方程式为__ (已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。

(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是
(2)加入锌粉的主要目的是
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为
您最近半年使用:0次



