名校
1 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示)
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是___________
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
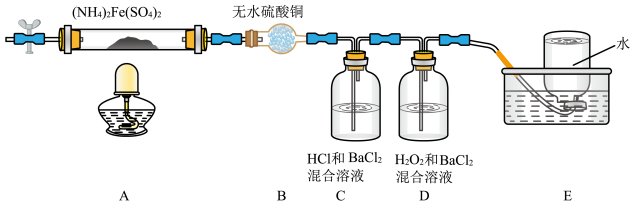
(4)B装置的作用是___________
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式___________ ;若去掉C,是否能得出同样结论,并解释其原因___________ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:___________ 。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | ___________ | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
2023-05-16更新
|
405次组卷
|
3卷引用:湖南省岳阳市平江县2023届高三下学期教学质量监测(三)化学试题
2 . 氯化氰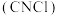 ,又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
,又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:

已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应; 具有较强的还原性。
具有较强的还原性。
②合成原理:在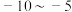 ℃条件下,
℃条件下,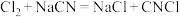 。
。
(1) 所含元素中第一电离能最大的是
所含元素中第一电离能最大的是___________ (填元素符号),B的作用是___________ 。
(2)F中干冰和丙酮的作用是降低温度,此时干冰___________ (填“升华”或“凝华”)。
(3)实验中,先向D中通入___________ (填“ ”或“
”或“ ”)。
”)。
(4)D中温度高于-5℃时,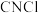 与
与 反应只生成
反应只生成 和气体X(纯净物,其结构中不含环状结构),X的电子式为
和气体X(纯净物,其结构中不含环状结构),X的电子式为___________ 。当G中___________ (填实验现象)时,停止通入 。
。
(5)本实验在通风橱中进行且操作者佩戴防毒面具,原因是___________ 。向盛有 溶液的试管中通入少量
溶液的试管中通入少量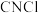 ,然后滴加一滴
,然后滴加一滴 溶液,溶液立即变为红色,
溶液,溶液立即变为红色, 和
和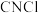 反应的离子方程式为
反应的离子方程式为___________ 。
(6)上述实验中, 完全反应时收集到
完全反应时收集到
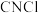 ,产率为
,产率为___________ %(结果保留整数)。
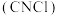 ,又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
,又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;
 具有较强的还原性。
具有较强的还原性。②合成原理:在
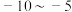 ℃条件下,
℃条件下,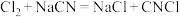 。
。(1)
 所含元素中第一电离能最大的是
所含元素中第一电离能最大的是(2)F中干冰和丙酮的作用是降低温度,此时干冰
(3)实验中,先向D中通入
 ”或“
”或“ ”)。
”)。(4)D中温度高于-5℃时,
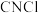 与
与 反应只生成
反应只生成 和气体X(纯净物,其结构中不含环状结构),X的电子式为
和气体X(纯净物,其结构中不含环状结构),X的电子式为 。
。(5)本实验在通风橱中进行且操作者佩戴防毒面具,原因是
 溶液的试管中通入少量
溶液的试管中通入少量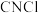 ,然后滴加一滴
,然后滴加一滴 溶液,溶液立即变为红色,
溶液,溶液立即变为红色, 和
和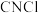 反应的离子方程式为
反应的离子方程式为(6)上述实验中,
 完全反应时收集到
完全反应时收集到
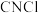 ,产率为
,产率为
您最近一年使用:0次
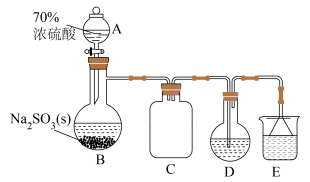
3 . 氯亚铂酸钾( )是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾(
)是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾(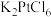 )为原料制备
)为原料制备 ,相关物质性质如下表:
,相关物质性质如下表:
Ⅰ.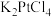 的制备
的制备
取10.00g氯铂酸钾(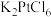 )溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原
)溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原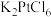 可得
可得 。
。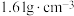 ,其物质的量浓度为
,其物质的量浓度为_____  。
。
(2)为使仪器A中的浓硫酸顺利滴下,需进行的操作为_____ 。
(3)仪器B的名称为_____ ,装置C的作用是_____ 。
(4)装置D中反应的化学方程式为_____ ,装置E中的试剂可选用_____ (填序号)。
A.氨水 B.NaOH溶液 C.澄清石灰水
(5)反应结束后,拆除装置,向装置D中加入足量无水乙醇,经过滤、洗涤、干燥,得红色固体6.25g。
①加入无水乙醇的目的是_____ 。
②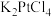 的产率为
的产率为_____ (结果保留三位有效数字)。_____ 。
(7)奥铂中H-N-H的键角大于1,2-环已二胺中H-N-H的键角,原因是_____ 。
(8)1,2-环己二胺的沸点(190℃)高于1,2-环戊二胺(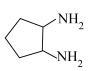 )的沸点(170℃),其主要原因是
)的沸点(170℃),其主要原因是_____ 。
 )是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾(
)是制备奥铂等抗肿瘤药物的重要中间体。某科研小组以氯铂酸钾(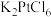 )为原料制备
)为原料制备 ,相关物质性质如下表:
,相关物质性质如下表:| 物质 | 性质 |
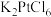 | 黄色粉末,溶于热水,微溶于冷水,几乎不溶于乙醇 |
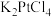 | 红色固体,溶于水,不溶于乙醇,高温易分解 |
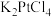 的制备
的制备取10.00g氯铂酸钾(
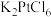 )溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原
)溶于热水,置于装置D中,按下图所示组装实验仪器(加热与夹持装置均已省略),在加热条件下还原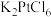 可得
可得 。
。
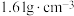 ,其物质的量浓度为
,其物质的量浓度为 。
。(2)为使仪器A中的浓硫酸顺利滴下,需进行的操作为
(3)仪器B的名称为
(4)装置D中反应的化学方程式为
A.氨水 B.NaOH溶液 C.澄清石灰水
(5)反应结束后,拆除装置,向装置D中加入足量无水乙醇,经过滤、洗涤、干燥,得红色固体6.25g。
①加入无水乙醇的目的是
②
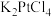 的产率为
的产率为Ⅱ.奥铂(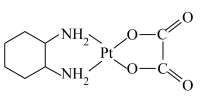 )是一种稳定的水溶性广谱抗肿瘤试剂,1,2-环己二胺(
)是一种稳定的水溶性广谱抗肿瘤试剂,1,2-环己二胺( )是制备奥铂的原料之一。
)是制备奥铂的原料之一。
(7)奥铂中H-N-H的键角大于1,2-环已二胺中H-N-H的键角,原因是
(8)1,2-环己二胺的沸点(190℃)高于1,2-环戊二胺(
 )的沸点(170℃),其主要原因是
)的沸点(170℃),其主要原因是
您最近一年使用:0次
名校
4 . 葡萄糖醛酸分子(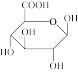 )发生分子内脱水可得葡萄糖醛酸内酯。葡萄糖醛酸内酯是一种具有广阔前景和较高研究价值的肝脏解毒剂。如下是以马铃薯淀粉为原料,制备葡萄糖醛酸内酯的绿色环保工艺。
)发生分子内脱水可得葡萄糖醛酸内酯。葡萄糖醛酸内酯是一种具有广阔前景和较高研究价值的肝脏解毒剂。如下是以马铃薯淀粉为原料,制备葡萄糖醛酸内酯的绿色环保工艺。
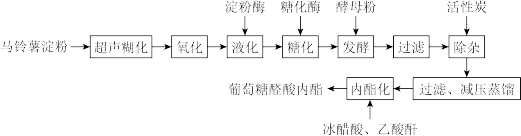
回答下列问题:
(1)葡萄糖醛酸分子中C、H、O第一电离能大小顺序为_______ (用元素符号表示)。
(2)氧化、液化、糖化过程均需控制在98℃,最合理的加热方式是_______ (填 “水浴”或“油浴”)。
(3)活性炭吸附除杂为_______ 过程 (填“物理”或“化学”)。
(4)除杂后的葡萄糖醛酸溶液的浓缩过程、内酯化过程均在减压蒸馏下进行,减压蒸馏装置如图所示(加热、夹持装置已略去)。减压蒸馏需控制温度在50℃。
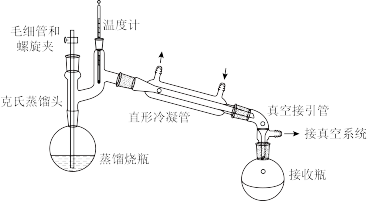
①该装置接真空系统的目的是_______ 。
②该装置中毛细管和螺旋夹的作用是_______ 。
(5)葡萄糖醛酸内酯含量测定的方法常用酸碱中和返滴定法。准确称取0.5000g试样,加入50mL蒸馏水充分溶解,再加入50mL0.1000 mol/L标准NaOH溶液(过量),充分反应,滴加2滴酚酞作指示剂并用0.1000 mol/L盐酸进行滴定,重复进行4次,得到如下实验数据:
已知葡萄糖醛酸内酯(C6H8O6, 相对分子质量为176)与NaOH按物质的量之比1:1进行反应。
①滴定达到终点的标志是_______ 。
②测定出葡萄糖醛酸内酯的质量分数为_______ 。
 )发生分子内脱水可得葡萄糖醛酸内酯。葡萄糖醛酸内酯是一种具有广阔前景和较高研究价值的肝脏解毒剂。如下是以马铃薯淀粉为原料,制备葡萄糖醛酸内酯的绿色环保工艺。
)发生分子内脱水可得葡萄糖醛酸内酯。葡萄糖醛酸内酯是一种具有广阔前景和较高研究价值的肝脏解毒剂。如下是以马铃薯淀粉为原料,制备葡萄糖醛酸内酯的绿色环保工艺。
回答下列问题:
(1)葡萄糖醛酸分子中C、H、O第一电离能大小顺序为
(2)氧化、液化、糖化过程均需控制在98℃,最合理的加热方式是
(3)活性炭吸附除杂为
(4)除杂后的葡萄糖醛酸溶液的浓缩过程、内酯化过程均在减压蒸馏下进行,减压蒸馏装置如图所示(加热、夹持装置已略去)。减压蒸馏需控制温度在50℃。

①该装置接真空系统的目的是
②该装置中毛细管和螺旋夹的作用是
(5)葡萄糖醛酸内酯含量测定的方法常用酸碱中和返滴定法。准确称取0.5000g试样,加入50mL蒸馏水充分溶解,再加入50mL0.1000 mol/L标准NaOH溶液(过量),充分反应,滴加2滴酚酞作指示剂并用0.1000 mol/L盐酸进行滴定,重复进行4次,得到如下实验数据:
| 组号 | 1 | 2 | 3 | 4 |
| VHCl/mL | 25.47 | 26.29 | 25.49 | 25.54 |
①滴定达到终点的标志是
②测定出葡萄糖醛酸内酯的质量分数为
您最近一年使用:0次



