名校
解题方法
1 . 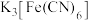 (铁氰化钾)常用于检验
(铁氰化钾)常用于检验 。某小组对
。某小组对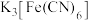 展开探究:
展开探究:
实验(一)制备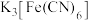 。
。
实验室用 氧化
氧化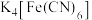 制备
制备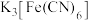 ,装置如图所示。
,装置如图所示。___________ 。
(2)理论上A中阴、阳两极产生气体的体积比为1:1,实验测得铜极、石墨极收集气体的体积比大于1:1(同温同压),其原因可能是___________ (答一条即可)。
实验(二)探究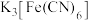 的电离程度。
的电离程度。
【提出问题】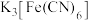 的阴离子团是否电离?
的阴离子团是否电离?
【提出假设】
假设1: 完全电离。
完全电离。
假设2: 部分电离。
部分电离。
假设3: 不电离。
不电离。
【设计实验】
【实验结论】
(3)实验结果: 。由此可知,假设
。由此可知,假设___________ (填“1”“2”或“3”)成立。用必要的化学用语和文字解释实验Ⅱ产生蓝色沉淀的原因:___________ 。
【交流反思】
(4)利用如图装置探究牺牲阳极法,一段时间后,设计实验探究锌是否保护了铁:___________ 。
(5)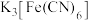 (铁氰化钾)、
(铁氰化钾)、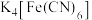 (亚铁氰化钾)是分析化学中两种常用的试剂。
(亚铁氰化钾)是分析化学中两种常用的试剂。
①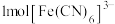 含
含___________  键。
键。
②配离子在水中的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为轨道的分裂能。由此可知, 的分裂能
的分裂能________ (填“大于”或“小于”) 。
。
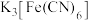 (铁氰化钾)常用于检验
(铁氰化钾)常用于检验 。某小组对
。某小组对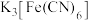 展开探究:
展开探究:实验(一)制备
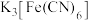 。
。实验室用
 氧化
氧化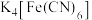 制备
制备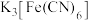 ,装置如图所示。
,装置如图所示。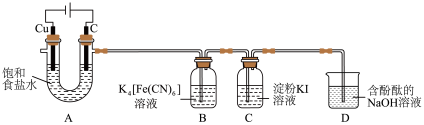
(2)理论上A中阴、阳两极产生气体的体积比为1:1,实验测得铜极、石墨极收集气体的体积比大于1:1(同温同压),其原因可能是
实验(二)探究
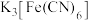 的电离程度。
的电离程度。【提出问题】
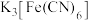 的阴离子团是否电离?
的阴离子团是否电离?【提出假设】
假设1:
 完全电离。
完全电离。假设2:
 部分电离。
部分电离。假设3:
 不电离。
不电离。【设计实验】
| 实验序号 | 操作及现象 |
| I | 在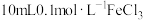 和 和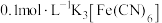 的混合溶液中插入一根无锈铁丝, 的混合溶液中插入一根无锈铁丝, 产生蓝色沉淀 产生蓝色沉淀 |
| Ⅱ | 在 溶液中插入一根无锈铁丝(与Ⅰ中相同), 溶液中插入一根无锈铁丝(与Ⅰ中相同),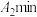 产生蓝色沉淀 产生蓝色沉淀 |
(3)实验结果:
 。由此可知,假设
。由此可知,假设【交流反思】
(4)利用如图装置探究牺牲阳极法,一段时间后,设计实验探究锌是否保护了铁:
(5)
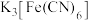 (铁氰化钾)、
(铁氰化钾)、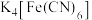 (亚铁氰化钾)是分析化学中两种常用的试剂。
(亚铁氰化钾)是分析化学中两种常用的试剂。①
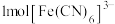 含
含 键。
键。②配离子在水中的颜色与分裂能大小有关。定义1个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量为轨道的分裂能。由此可知,
 的分裂能
的分裂能 。
。
您最近一年使用:0次
2024-02-02更新
|
308次组卷
|
2卷引用:广东省湛江市2023-2024学年高三上学期1月期末化学试题
名校
2 . 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂,是一种复盐,一般亚铁盐在空气中易被氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,利用这一性质可以用等物质的量的(NH4)2SO4和FeSO4混合制备。请回答以下问题:
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示)
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是___________
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。
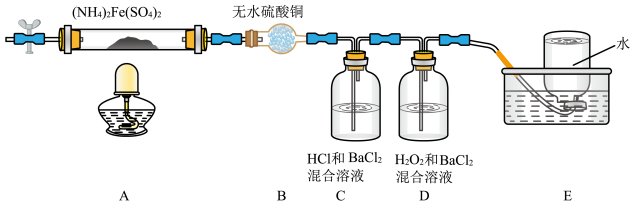
(4)B装置的作用是___________
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式___________ ;若去掉C,是否能得出同样结论,并解释其原因___________ 。
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:___________ 。
I.硫酸亚铁铵晶体的制备
步骤一:称取3.0 g铁屑,加入15 mL 10% Na2CO3溶液,小火加热30分钟,过滤洗涤、干燥、称量得固体m1 g。
步骤二:将步骤一中的m1 g固体转移至锥形瓶,加入15 mL 3 mol·L-1 H2SO4,加热至不再有气体生成,趁热过滤,洗涤固体,将滤液和洗涤液合并后转移至蒸发皿中备用,准确称量剩余固体质量得m2 g。
步骤三:计算所得FeSO4的物质的量,计算等物质的量的(NH4)2SO4固体的质量,准确称取(NH4)2SO4。
步骤四:将(NH4)2SO4固体加入蒸发皿中,缓慢加热浓缩至表面出现结晶薄膜为止,放置冷却。
步骤五:经过一系列操作,最终得到较纯净的(NH4)2FeSO4·6H2O。
(1)N、O、H三种元素的第一电离能由大到小的顺序为
(2)步骤一中加入10% Na2CO3溶液,小火加热30分钟的目的是
(3)关于步骤五中的一系列操作的相关表述,错误的是___________(填字母)。
| A.过滤时可使用玻璃棒搅拌的方式来缩短时间 |
| B.过滤和洗涤的速度都要尽可能的快,可以减少产品的氧化 |
| C.洗涤时使用无水乙醇既可以洗去晶体表面的杂质离子,又可以起到干燥作用 |
| D.所得的产品可以采取电热炉烘干的方式彻底干燥 |
II.硫酸亚铁铵的分解
已知硫酸亚铁铵在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500 ℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(4)B装置的作用是
(5)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定分解产物中的某种气体,写出D中发生反应的离子方程式
(6)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3而不含FeO。其预期实验现象为:
| 实验步骤 | 预期现象 | 结论 |
| ①取少量A中残留物于试管中,加入适量稀硫酸,充分振荡便其完全溶解; ②将溶液分成两份,分别滴加高锰酸钾溶液、KSCN溶液 | ___________ | 固体残留物仅为Fe2O3 |
您最近一年使用:0次
2023-05-16更新
|
407次组卷
|
3卷引用:江西省宜春市高安市灰埠中学2022-2023学年高二下学期7月期末化学试题
名校
解题方法
3 . 含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有 NO 等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O — NaCl + HNO3 (未配平)。
(1)氯在元素周期表中的位置是_______ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。其所在周期的元素中,第一电离能最大的是______ (填化学式)。
(2)配平上述反应方程式_______ 。每有 0.3mol 电子发生转移,可消耗标准状况下 NO 气体的体积约为______ L。
(3)NaClO 溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。
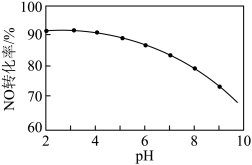
(4)NaClO 溶液的初始pH 越大,NO 的转化率越________ (填“高”或“低”),其原因是_________ 。
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
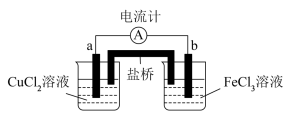
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式________ ;盐桥在原电池中所起的作用(任意写出一条)__________ 。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
(3)NaClO 溶液中存在如下关系:c(OH-)
其他条件相同,随着 NaClO 溶液初始 pH(用稀硫酸调节)的不同,NO 转化率如图。

(4)NaClO 溶液的初始pH 越大,NO 的转化率越
(5)取少量 NaClO 溶液和 KClO3 溶液,分别置于 A 试管和 B 试管,滴加试剂,观察现象,记录于下表。请将表格填写完整。
| 滴加 KI 溶液 | 再滴加 CCl4,振荡、静置 | 结论 | |
| A 试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
| B 试管 | 无现象 | 溶液分层,均无色 |
(6)某化学学习小组设计原电池装置如下图 (a 为铜电极 b 为石墨电极) :,请写出负极的电极反应式

您最近一年使用:0次
解题方法
4 . 已知X、Y、Z、Q是原子序数依次增大的前四周期元素。其中X元素基态原子K层电子有1个未成对电子;Y元素原子第二能层的最高能级不同轨道上都有电子,且仅有1个未成对电子;Z元素原子次外层最高能级电子排布式为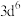 ;
;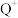 的3d轨道处于全充满状态。请用
的3d轨道处于全充满状态。请用化学用语或相关叙述 按要求回答下列问题。
(1)X元素处于周期表五个区中的_______ 区。
(2)Y原子的轨道表示式为_______ 。
(3)X、Y元素的电负性:_______ >_______ (填元素符号)。
(4)与X属同一主族的短周期元素中,第一电离能最小的是_______ (填元素符号)。
(5)关于Q元素:
①周期表中的位置为_______ ;
②基态原子的简化电子排布式为_______ ;
(6)为探究Fe、Cu金属活动性的相对强弱,某同学设计了如下两个实验方案。
①方案1:将外形相同的Fe片和Cu片分别同时放入等量的稀硫酸中,观察现象。写出涉及反应的离子方程式:_______ 。
②方案2:利用Fe片、Cu片、稀硫酸、导线等设计原电池。
ⅰ.在方框中补全原电池装置示意图并标注电极材料、电极名称和电解质溶液 _______ 。

ⅱ.该原电池工作时,能证明Fe比Cu金属活动性强的现象为_______ 。
ⅲ.写出正极反应式:_______ 。
③结合已有知识,请设计不同于上述的实验方案。所需试剂有_______ 。涉及反应的离子方程式为_______ 。
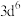 ;
;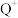 的3d轨道处于全充满状态。请用
的3d轨道处于全充满状态。请用(1)X元素处于周期表五个区中的
(2)Y原子的轨道表示式为
(3)X、Y元素的电负性:
(4)与X属同一主族的短周期元素中,第一电离能最小的是
(5)关于Q元素:
①周期表中的位置为
②基态原子的简化电子排布式为
(6)为探究Fe、Cu金属活动性的相对强弱,某同学设计了如下两个实验方案。
①方案1:将外形相同的Fe片和Cu片分别同时放入等量的稀硫酸中,观察现象。写出涉及反应的离子方程式:
②方案2:利用Fe片、Cu片、稀硫酸、导线等设计原电池。
ⅰ.在方框中

ⅱ.该原电池工作时,能证明Fe比Cu金属活动性强的现象为
ⅲ.写出正极反应式:
③结合已有知识,请设计不同于上述的实验方案。所需试剂有
您最近一年使用:0次
名校
解题方法
5 . ZnS、CdSe均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。
(1)基态Zn原子的价层电子排布式为_______ 。
(2)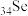 在周期表中的位置为
在周期表中的位置为_______ 。
(3)S与P在周期表中是相邻元素,两者的第一电离能:S_______ P(填“>”、“<”或“=”),解释其原因_______ 。
(4)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。_______ 个。
②已知,晶胞边长a nm,阿伏加德罗常数为 ,CdSe的摩尔质量为
,CdSe的摩尔质量为 。则CdSe晶体的密度是
。则CdSe晶体的密度是_______  。(1nm=10-7cm)
。(1nm=10-7cm)
(5)电化学沉积法可用于制备CdSe,其装置示意图如下。
①已知,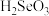 是弱酸。控制合适的电压,可以使
是弱酸。控制合适的电压,可以使 转化为纯净的CdSe,写出阴极的电极反应式:
转化为纯净的CdSe,写出阴极的电极反应式:_______ 。
②研究表明,为得到更致密均匀的CdSe薄膜,可用二甲基甲酰胺( )做溶剂降低
)做溶剂降低 浓度,从结构的角度分析原因:
浓度,从结构的角度分析原因:_______ 。
(1)基态Zn原子的价层电子排布式为
(2)
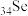 在周期表中的位置为
在周期表中的位置为(3)S与P在周期表中是相邻元素,两者的第一电离能:S
(4)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。

②已知,晶胞边长a nm,阿伏加德罗常数为
 ,CdSe的摩尔质量为
,CdSe的摩尔质量为 。则CdSe晶体的密度是
。则CdSe晶体的密度是 。(1nm=10-7cm)
。(1nm=10-7cm)(5)电化学沉积法可用于制备CdSe,其装置示意图如下。

①已知,
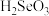 是弱酸。控制合适的电压,可以使
是弱酸。控制合适的电压,可以使 转化为纯净的CdSe,写出阴极的电极反应式:
转化为纯净的CdSe,写出阴极的电极反应式:②研究表明,为得到更致密均匀的CdSe薄膜,可用二甲基甲酰胺(
 )做溶剂降低
)做溶剂降低 浓度,从结构的角度分析原因:
浓度,从结构的角度分析原因:
您最近一年使用:0次
2023-01-05更新
|
455次组卷
|
4卷引用:北京市丰台区2022-2023学年高三上学期期末考试化学试题



