1 . 元素周期表(律)在学习元素及其化合物知识和科学研究中有着重要作用,联合国大会将2019年定为“化学元素周期表国际年”。下表是局部的元素周期表(部分元素用字母表示),请回答下列问题:

(1)a、b、e的原子半径由大到小的顺序为___ (用元素符号表示).
(2)上表所列元素的最高价氧化物对应水化物中酸性最强的是______ (写化学式),金属性最强的元素有______ (写元素符号)。
(3)f、g、h三种元素的气态氢化物中,最稳定的氢化物是______ (写化学式),写出该氢化物在水中的电离方程式___________________________ 。
(4)某元素的2种核素的结构如图所示,该元素为上表中的元素(填写上表中“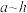 ”字母);图示的2种核素属于______(单选)。
”字母);图示的2种核素属于______(单选)。

(5)元素g的一种氧化物常用于漂白纸浆、草帽辫等.该氧化物具有还原性,在一定条件下能与常见氧化剂发生反应,写出其中一个反应的化学方程式:__________ 。
元素的电负性(x)是表示元素原子在分子内吸收电子能力的大小,也是元素的重要性质之一。下表给出了14种元素的电负性数值:
(6)分析上表中元素原子的原子序数与元素电负性的数据,可以得到以下规律______(双选)。
(7)根据你所归纳的元素电负性的变化规律,预测钙元素的电负性可能为______(单选)。
(8)经验规律告诉我们:当成键的两原子相应元素的电负性差值 时,一般形成离子键;当
时,一般形成离子键;当 时,一般形成共价键。请判断
时,一般形成共价键。请判断 含有的化学键是
含有的化学键是______ ;写出 的电子式
的电子式______ 。

(1)a、b、e的原子半径由大到小的顺序为
(2)上表所列元素的最高价氧化物对应水化物中酸性最强的是
(3)f、g、h三种元素的气态氢化物中,最稳定的氢化物是
(4)某元素的2种核素的结构如图所示,该元素为上表中的元素(填写上表中“
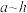 ”字母);图示的2种核素属于______(单选)。
”字母);图示的2种核素属于______(单选)。
| A.同分异构体 | B.同素异形体 | C.同系物 | D.同位素 |
元素的电负性(x)是表示元素原子在分子内吸收电子能力的大小,也是元素的重要性质之一。下表给出了14种元素的电负性数值:
元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.50 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
元素 | Mg | N | Na | O | P | S | K |
电负性 | 1.21 | 3.04 | 0.94 | 3.44 | 2.19 | 2.58 | 0.8 |
| A.同周期元素,随着原子序数的递增,元素的电负性依次减小 |
| B.同周期元素,随着原子序数的递增,元素的电负性依次增大 |
| C.同主族元素,随着原子序数的递增,元素的电负性依次减小 |
| D.同主族元素,随着原子序数的递增,元素的电负性依次增大 |
| A.0.60 | B.1.0 | C.1.3 | D.1.5 |
 时,一般形成离子键;当
时,一般形成离子键;当 时,一般形成共价键。请判断
时,一般形成共价键。请判断 含有的化学键是
含有的化学键是 的电子式
的电子式
您最近一年使用:0次
名校
解题方法
2 . 非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__ ;第一电离能I1(Si)__ I1(Ge)(填>或<)。
(2)基态Ge原子核外电子排布式为__ ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是__ 。
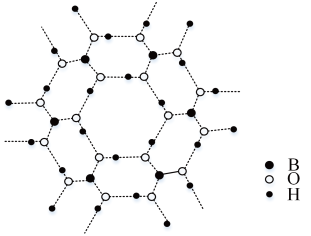
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为__ ;硼酸在热水中比在冷水中溶解度显著增大的主要原因是__ 。
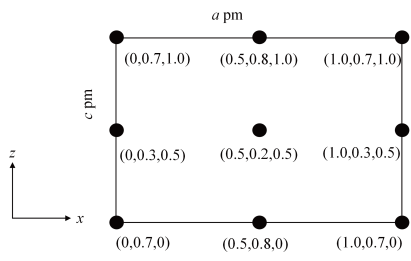
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为__ ;CsSiB3O7的摩尔质量为Mg.mol-1,设NA为阿伏加 德罗常数的值,则CsSiB3O7晶体的密度为__ g·cm-3(用代数式表示)。
(1)C、O、Si三种元素电负性由大到小的顺序为
(2)基态Ge原子核外电子排布式为
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为

您最近一年使用:0次
2020-03-12更新
|
380次组卷
|
12卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题江苏省徐州一中2019-2020学年高二上学期期末调研测试化学试题【省级联考】山东省2020届新高考模拟统考化学试题山东省菏泽市菏泽第一中学2020届高三下学期在线考试化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)专题讲座(十一) 晶胞参数、坐标参数的分析与应用(精讲)-2021年高考化学一轮复习讲练测广东省河源中学2021届高三上学期第二次质量检测化学试题(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 章末综合检测卷广东省深圳市龙岗区2020-2021学年高三第一次调研考试化学试题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)



