1 .  是周期表中
是周期表中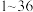 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
(1) 的电子式为
的电子式为______________ , 中含有的化学键类型为
中含有的化学键类型为______________ .
(2)B、C两种元素的第三电离能由大到小的顺序为______________ (填元素符号)
(3)E在元素周期表中位置为______________ ,位于元素周期表的______________ 区.
(4)比较:①键角大小:
______________  ;②在水中的溶解性大小
;②在水中的溶解性大小
______________  ;
;
 是周期表中
是周期表中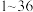 号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.
号的元素,它们的原子序数递增,对它们的性质及结构的描述如下:A的基态原子只有一种形状的电子云,并容易形成共价键;B的基态原子有3个不同的能级,各能级中电子数相等;C与B同周期,其第一电离能高于周期表中与之相邻的所有元素;D在周期表中位于C的下一周期,其电负性在同周期主族元素中最大;E的基态原子在前四周期中未成对电子数最多.(1)
 的电子式为
的电子式为 中含有的化学键类型为
中含有的化学键类型为(2)B、C两种元素的第三电离能由大到小的顺序为
(3)E在元素周期表中位置为
(4)比较:①键角大小:
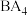
 ;②在水中的溶解性大小
;②在水中的溶解性大小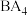
 ;
;
您最近一年使用:0次
名校
2 . 依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
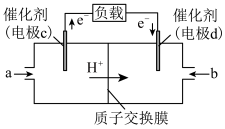
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近一年使用:0次



