名校
解题方法
1 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为_______ ,其电子占据最高能级的电子云轮廓图为_______ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是_______ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
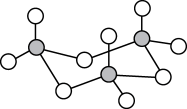
(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:_______ 。
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: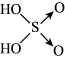 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。
①请写出亚磷酸的结构式_______ 。
② 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| H2S | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。①请写出亚磷酸的结构式
②
 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显___ 价,配位数是___ 。
(5)根据价层电子对互斥理论判断N3-的空间构型为___ 。与N3-互为等电子体的分子有___ (写一种即可)。
(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.HNO2是强酸
(2)叠氮酸根(N3-)能与许多金属离子等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显
(5)根据价层电子对互斥理论判断N3-的空间构型为
您最近一年使用:0次



