名校
解题方法
1 . 实验室中利用如图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
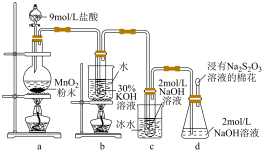
(1)盛放9mol/L盐酸的仪器名称是_______ 。
(2)b中发生化学反应的离子方程式是_______ 。
(3)d中浸有 溶液的棉花的作用是
溶液的棉花的作用是_______ 。
(4)下列相关说法不正确的是_______(填标号)。
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是_______ 。
(6)取少量 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO_______ 。(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、 溶液)
溶液)
(7) 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
(1)盛放9mol/L盐酸的仪器名称是
(2)b中发生化学反应的离子方程式是
(3)d中浸有
 溶液的棉花的作用是
溶液的棉花的作用是(4)下列相关说法不正确的是_______(填标号)。
| A.使用选择9mol/L盐酸替换浓盐酸,有利于减少HCl挥发 |
| B.控制液体滴加速率以维持氯气气流稳定,有利于减少反应过程倒吸的可能 |
C.反应结束后,b中液体经冷却结晶、过滤、冷水洗涤、干燥,可得 晶体 晶体 |
| D.增大装置c中NaOH溶液的浓度,有利于提高NaClO产率 |
(5)当b中试管内溶液由黄色变为无色时,反应到达终点。实际操作时,发现溶液由黄色变为紫红色甚至产生棕色沉淀影响产品纯度。针对该现象,可能混入的物质是
(6)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加
和NaClO溶液分别置于1号和2号试管中,滴加 溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下
溶液。两支试管均无明显现象,但试管2试管壁发烫。在上述实验基础上,设计实验进一步验证该条件下 的氧化能力小于NaClO
的氧化能力小于NaClO 溶液)
溶液)(7)
 中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
中氧原子的p轨道上的孤对电子进入氯原子的d轨道形成d-pπ键。d-pπ键长:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
解题方法
2 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
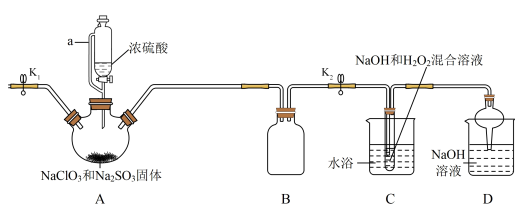
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
2023-10-27更新
|
1110次组卷
|
5卷引用:广西南宁市2024届高三上学期毕业班摸底测试化学试题
广西南宁市2024届高三上学期毕业班摸底测试化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题广西部分高中2024届高三第一次摸底测试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)



