1 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1)卤族元素在周期表中处于_______ 区。
(2)卤族元素化合物的性质有相似性和递变性,下列说法不正确 的是_______。
(3)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_______ 。N原子的轨道杂化类型为_______ 。
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是_______ 。
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为anm。
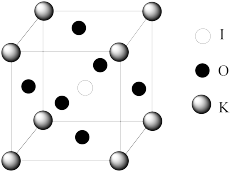
①该晶体的化学式为_______ 。
②与钾原子紧邻的氧原子个数为_______ 。
③已知阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm-3(列式表示)。
| 元素 | H | N | F | Cl | Br | I |
| 电负性 | 2.1 | 3.0 | 4.0 | 3.0 | 2.8 | 2.5 |
(2)卤族元素化合物的性质有相似性和递变性,下列说法
| A.HF、HCl、HBr的沸点依次升高 |
| B.Cl2、ICl、IBr沸点依次升高 |
| C.NaF、NaCl、NaBr熔点依次降低 |
| D.H-O-X(X代表Cl、Br、I)的酸性随着X的原子序数递增逐渐增强 |
①NF3的空间结构名称为
②NH3具有碱性(可与H+结合)而NF3没有碱性,原因是
(4)某晶体含有K、I、O三种元素,是一种性能良好的非线性光学材料,其晶胞结构如下图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,边长为anm。

①该晶体的化学式为
②与钾原子紧邻的氧原子个数为
③已知阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2 . 主族元素N、Si、F、Cl、Se、Ca等的某些化合物对工农业生产意义重大。
(1)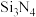 陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为
陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为___________ 。
(2) 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是___________ 。
(3)硒元素位于元素周期表中___________ (选填s、p、d、f、ds)区,基态硒原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为___________ 。
(4) 的中心原子杂化方式为
的中心原子杂化方式为___________ , 的空间构型是
的空间构型是___________ ,与 互为等电子体的微粒有
互为等电子体的微粒有___________ (写一种微粒即可)。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为___________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,将原子位置的坐标表示为晶胞棱长的分数,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标:A点为 、B点为
、B点为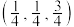 ,则C点原子的分数坐标为
,则C点原子的分数坐标为___________ 。

(6)已知: 称为羟基,无机含氧酸(
称为羟基,无机含氧酸( )分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致
)分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致 中的O的电子向R偏移,
中的O的电子向R偏移,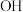 键极性增强,因而在水分子的作用下,也就越容易电离出
键极性增强,因而在水分子的作用下,也就越容易电离出 ,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。
,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。
亚磷酸( )为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性
)为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性___________ (填“强”或“弱”), 与过量NaOH溶液反应的离子方程式为
与过量NaOH溶液反应的离子方程式为___________ 。
(7)萤石( )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是___________ ,若该立方晶胞参数为acm,阴、阳离子的核间距最小为___________ cm。

(1)
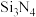 陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为
陶瓷具有硬度大、强度高、耐高温等性质,其晶体类型为(2)
 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是(3)硒元素位于元素周期表中
(4)
 的中心原子杂化方式为
的中心原子杂化方式为 的空间构型是
的空间构型是 互为等电子体的微粒有
互为等电子体的微粒有(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为
 、B点为
、B点为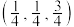 ,则C点原子的分数坐标为
,则C点原子的分数坐标为
(6)已知:
 称为羟基,无机含氧酸(
称为羟基,无机含氧酸( )分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致
)分子结构中含有羟基,如果成酸元素R相同,含氧酸分子中非羟基氧个数越多,R的正电性越高,导致 中的O的电子向R偏移,
中的O的电子向R偏移,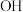 键极性增强,因而在水分子的作用下,也就越容易电离出
键极性增强,因而在水分子的作用下,也就越容易电离出 ,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。
,即酸性越强。也就是说,无机含氧酸的酸性随着分子中连接在中心原子R上的非羟基氧的个数增多而增强。亚磷酸(
 )为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性
)为弱酸,分子结构中含有一个非羟基氧,其酸性比HClO的酸性 与过量NaOH溶液反应的离子方程式为
与过量NaOH溶液反应的离子方程式为(7)萤石(
 )是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是
您最近一年使用:0次



