真题
解题方法
1 . 配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。______ 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为______ 形;每个L2-中采取sp2杂化的C原子数目为______ 个,C与O之间形成σ键的数目为______ 个。
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入______ 。(假设X晶胞形状不变)。
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。______ 。
②X晶体中Zn2+的配位数为______ 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为_____ nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为_____ g•cm-3(列出化简的计算式)。
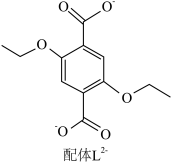
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
| A.-Cl | B.-OH | C.-NH2 | D.-CH3 |
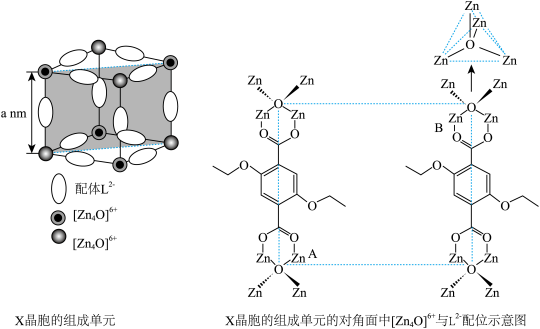
②X晶体中Zn2+的配位数为
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为
您最近一年使用:0次



