1 . (NH4)2Fe(SO4)2·6H2O(M=392g/mol)又称摩尔盐,简称FAS,它是浅蓝色绿色晶体,可溶于水,难溶于水乙醇。某小组利用工业废铁屑进行下列实验。请按要求回答下列问题:
Ⅰ. FAS的制取。流程如下:
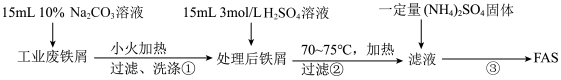
(1)步骤①加热的目的是_________________________ 。
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):______________ 。
Ⅱ.NH4+含量的测定。装置如图所示:
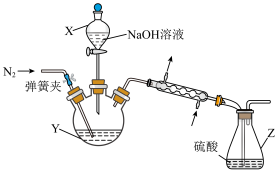
实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称______________ ;N2的电子式为______________ 。
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是__________________ ;NH4+质量百分含量为(用代数式表示)__________________ 。
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)_________ 。滴定中反应的离子方程式为____________________ 。
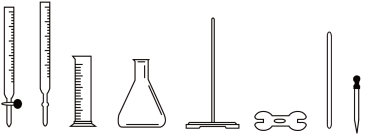
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液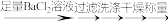 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________ 。
(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是_______________ ;为验证该猜测正确,设计后续实验操作为_________________ ,现象为______________ 。
Ⅰ. FAS的制取。流程如下:

(1)步骤①加热的目的是
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):
Ⅱ.NH4+含量的测定。装置如图所示:

实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)

① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液
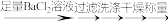 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是
您最近一年使用:0次
2019-04-28更新
|
289次组卷
|
2卷引用:【区级联考】天津市河西区2019届高三下学期二模考试化学试题
2 . 某学习小组欲从含有[Cu(NH3)4]SO4、乙醇和氨水的实验室废液中分离乙醇并制备硫酸铜铵[CuSO4·(NH4)2SO4]固体,完成了如下实验:
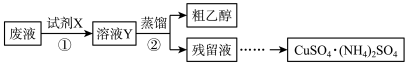
已知:[Cu(NH3)4]2++4H+==Cu2++4NH4+
请回答:
(1)步骤①中,试剂X应采用_____________________________________________ 。
(2)甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇含量明显偏低,可能的原因是_______________________________________________ 。
(3)设计实验方案验证硫酸铜铵固体中的NH4+___________________________________________

已知:[Cu(NH3)4]2++4H+==Cu2++4NH4+
请回答:
(1)步骤①中,试剂X应采用
(2)甲、乙两同学取相同量的溶液Y分别进行蒸馏,收集到的馏出液体积相近,经检测,甲同学的馏出液中乙醇含量明显偏低,可能的原因是
(3)设计实验方案验证硫酸铜铵固体中的NH4+
您最近一年使用:0次
2018-11-09更新
|
1173次组卷
|
3卷引用:浙江省普通高校招生选考科目2018年4月考试化学试题
浙江省普通高校招生选考科目2018年4月考试化学试题浙江省诸暨中学2019-2020学年高一下学期期中考试化学(学考)试题(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)
解题方法
3 . 某学习小组进行“铁与水反应所得固体物质的成分、性质及再利用”的实验探究。
【探究一】设计下图所示装置进行“铁与水反应”的实验。

(1)反应前A中投放碎瓷片的目的是__________________ 。
(2)硬质玻璃管B中发生反应的化学方程式为_______________ 。
(3)装置E中的现象是__________________ 。
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为_______ ;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为_______ 。
①只有有Fe ②只有Fe3O4 ③Fe3O4和Fe ④一定有Fe3O4,可能有Fe
(5)若要检测溶液中是否存在Fe 2+,则另一份溶液中需要加入______ (填试剂)来检验。
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(6)计算反应后B装置中铁元素的质量分数为_______ 。
【探究一】设计下图所示装置进行“铁与水反应”的实验。

(1)反应前A中投放碎瓷片的目的是
(2)硬质玻璃管B中发生反应的化学方程式为
(3)装置E中的现象是
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分。
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份。
(4)一份滴加几滴KSCN溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为
①只有有Fe ②只有Fe3O4 ③Fe3O4和Fe ④一定有Fe3O4,可能有Fe
(5)若要检测溶液中是否存在Fe 2+,则另一份溶液中需要加入
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(6)计算反应后B装置中铁元素的质量分数为
您最近一年使用:0次
10-11高三下·重庆·阶段练习
4 . 欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人设计如F实验装置:

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 。
(2)装置中B瓶的作用是 。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:________。
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量 的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)
①反应中除生成NO2气体外还会有少量的NO生成;
②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。
为完成测定并验证有NO生成,有人设计如F实验装置:

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是 。
(2)装置中B瓶的作用是 。
(3)实验时A中反应停止后,打开D装置导管的活塞K2并通入氧气,若反应确有NO产生,D中的现象是 ;实验时发现通入氧气温度的高低对实验有较大的影响,为便于观察应通入____(填“冷”或“热”)的氧气,其原因是:________。
(4)若实验只测定Cu的质量分数,不检验NO的产生,则在铜银合金与浓硝酸反应后,只需加入过量的____(填一种物质的化学式,下同)溶液,过滤、洗涤、干燥称量 的质量就可达目的。(已知Cu(OH)2与AgOH类似,也可以溶于过量的氨水而形成溶液。)
您最近一年使用:0次



