名校
1 . 胆矾(CuSO4·5H2O)又名蓝矾,是化学工业、医药领域中的常见物质。某实验小组利用有色金属加工企业的废材制得粗胆矾晶体。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加_______ 至过量,先析出沉淀,后沉淀部分溶解,过滤得深蓝色溶液,滤渣为红褐色;
③另取少量①所得溶液,加入足量的_______ 溶液,出现白色沉淀;
④取③中所得上层清液,加入_______ 溶液,无明显现象。
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-= ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6
请回答:步骤①中,加入足量NaF溶液的可能原因是_______ ,若不加NaF溶液,可导致最终的测量值_______ (填 “偏大”“偏小”或“无影响”)。滴加KI溶液生成沉淀的离子方程式为_______ ; 若Na2S2O3标准溶液的平均用量为10.00 mL,则产品中胆矾的质量分数为_______ 。
(1)制得的粗晶体中可能含有Fe2(SO4)3、FeCl3 杂质,选用下列试剂,确定所含杂质。可选试剂有:蒸馏水、稀硫酸、氨水、Ba(NO3)2 溶液、BaCl2 溶液、AgNO3 溶液。请补充以下实验步骤:
①取一定量样品,加入蒸馏水、稀硫酸,固体溶解,得到蓝色透明溶液;
②取少量①所得溶液,滴加
③另取少量①所得溶液,加入足量的
④取③中所得上层清液,加入
实验结论:粗胆矾晶体中含有Fe2(SO4)3,不含FeCl3。
(2)CuSO4·5H2O的含量测定:
①称取1.250g产品配成100 mL溶液,取25.00 mL溶液于锥形瓶中,加入足量NaF溶液后,再滴加KI溶液至不再产生CuI沉淀;
②以淀粉溶液作为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液进行滴定,平行滴定3次。已知:Fe3++6F-=
 ;I2+2Na2S2O3=2NaI+Na2S4O6
;I2+2Na2S2O3=2NaI+Na2S4O6请回答:步骤①中,加入足量NaF溶液的可能原因是
您最近一年使用:0次
名校
解题方法
2 . 某同学为测定某NaHCO3(含少量NaCl)固体中NaHCO3的含量,设计如下实验。
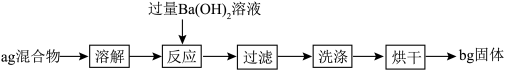
下列说法错误的是

下列说法错误的是
A.NaHCO3的质量分数为: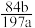 |
| B.可通过恒重操作确保固体完全烘干 |
C.反应的离子方程式为:HCO +Ba2++OH-=BaCO3↓+H2O +Ba2++OH-=BaCO3↓+H2O |
| D.确定Ba(OH)2是否过量的操作:取上层清液,继续加Ba(OH)2溶液,看有无沉淀生成 |
您最近一年使用:0次
2023-04-14更新
|
315次组卷
|
3卷引用:上海市虹口区2022~2023学年高三下学期二模测试化学试题
上海市虹口区2022~2023学年高三下学期二模测试化学试题(已下线)化学-2023年高考押题预测卷01(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)宁夏平罗中学2022-2023学年高二下学期期末考试化学试题
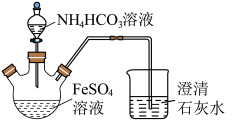
3 . 碳酸亚铁(FeCO3)难溶于水,常用于制取铁盐或补血剂。一种FeCO3的制备装置如图所示。实验中观察到三颈烧瓶中有大量白色沉淀产生,烧杯中溶液变浑浊,恰好完全反应时,三颈烧瓶内溶液中只含一种溶质。过滤后可得FeCO3沉淀。______________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是___________ 。
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:__________________ 。
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程_________ 。
(2)反应后所得沉淀需进行过滤、洗涤。检验沉淀已经洗涤干净的方法是
(3)FeCO3在潮湿的空气中会转化为Fe(OH)3并进步转化为Fe2O3。写出FeCO3在潮湿的空气中转化为Fe(OH)3的化学方程式:
(4)某FeCO3固体被部分氧化,为测定其中Fe3+的质量分数,现进行如下实验:称取5.000g固体样品,加足量盐酸溶解,将溶液稀释至100mL,量取20.00mL该溶液,加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0.1000mol/LNa2S2O3溶液滴定,当滴定至终点时消耗Na2S2O3溶液20.00mL。已知实验过程中发生反应如下:2Fe3++2I-=2Fe2++I2,I2+2S2O
 =S4O
=S4O +2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
+2I-。计算FeCO3固体样品中Fe3+的质量分数,写出计算过程
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。

①写出制备 的化学方程式:
的化学方程式:________________ 。
②“一系列操作”包括________ 、________ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:_______ 。
(3)临床上, 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: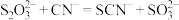 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为________________ 。
(4)工业上,测定 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
相关反应: ;
;
 。
。
①该样品中 的质量分数为
的质量分数为________ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会________ (填“偏高”、“偏低”或“无影响”)。
 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。(1)实验室可通过向含
 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。
①写出制备
 的化学方程式:
的化学方程式:②“一系列操作”包括
(2)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,
 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: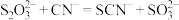 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为(4)工业上,测定
 样品纯度的方法:取
样品纯度的方法:取 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。相关反应:
 ;
; 。
。①该样品中
 的质量分数为
的质量分数为②如果稀硫酸过多,测得结果会
您最近一年使用:0次
名校
5 . 二氧化铈 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
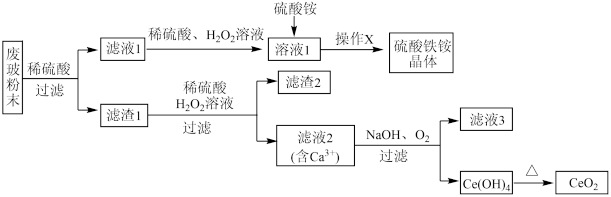
已知: 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。
回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、____ ;“操作X”是将溶液1______________ 、过滤、洗涤、干燥得到硫酸铁铵晶体。
(2)向滤液1中加入稀硫酸、 溶液的目的是
溶液的目的是______ 。滤渣1中加稀硫酸和溶液发生反应的离子方程式为_____________ 。
(3)要证明滤液1中含有 ,可选用的试剂为
,可选用的试剂为_________ 。
(4)由滤液2生成 的离子方程式为
的离子方程式为__________ 。
(5)取上述流程中得到的 产品
产品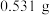 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为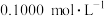 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗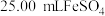 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为______ (结果保留两位有效数字)。
 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含 、
、 、
、 、
、 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
已知:
 不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于 溶液。
溶液。回答下列问题:
(1)废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、
(2)向滤液1中加入稀硫酸、
 溶液的目的是
溶液的目的是(3)要证明滤液1中含有
 ,可选用的试剂为
,可选用的试剂为(4)由滤液2生成
 的离子方程式为
的离子方程式为(5)取上述流程中得到的
 产品
产品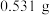 ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为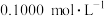 的
的 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为 ),消耗
),消耗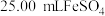 标准溶液.该产品中
标准溶液.该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
2020-11-27更新
|
163次组卷
|
2卷引用:山东省济宁市泗水县2021届高三上学期期中考试化学试题
名校
6 . 硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
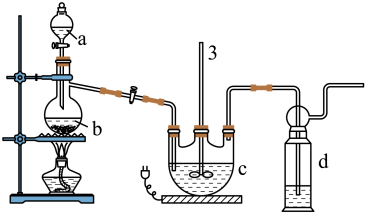
(1)仪器a的名称是_______ ,仪器b的名称是_______ 。b中利用质量分数为70%〜80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______ 。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______ mol∙L-1
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是
(2)实验中要控制SO2的生成速率,可以采取的措施有
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
| 装置 | 试剂X | 实验现象 |
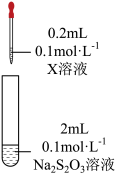 | Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为
您最近一年使用:0次
2020-04-20更新
|
816次组卷
|
6卷引用:2020届陕西省汉中市重点中学高三4月开学第一次联考理综-化学试题
名校
7 . 硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:(已知:FeS2与H2SO4不反应)
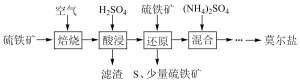
(1)莫尔盐属于____________ 。
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有__________ ,若150kg硫铁矿(FeS2质量分数为80%)完全反应转移电子数为________________________
(3)加H2SO4酸浸,发生反应的离子方程式为________________________________ 。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:_________________________________ 。
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中, _______________ 证明含有Fe2+和NH4+。

(1)莫尔盐属于
A、酸式盐 B、碱式盐 C、复盐 D、硫酸盐
(2)硫铁矿焙烧的主反应是:4FeS2+11O2
 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有(3)加H2SO4酸浸,发生反应的离子方程式为
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。
反应Ⅰ的离子方程式为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+
反应Ⅱ的离子方程式为:
(5)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于
您最近一年使用:0次
解题方法
8 . 某工业废催化剂含有 SiO2、ZnO、CuS、ZnS、Fe3O4 等物质,为落实“节约资源,变 废为宝”的环保理念,某课外兴趣小组的同学取 20g 该物质进行实验,回收其中的 Cu 和 Zn,实验方案如下:

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是______ 溶液。

(2)滤液Ⅰ中的 Fe2+最好用______ 来检验。
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是______ (填元素符号),由滤液Ⅱ、Ⅳ滤液获得 ZnSO4•7H2O 的操作是______________ 。
(4)第二次浸出时的化学方程式为_______________ 。
(5)加 A 调节溶液的 pH 约为______ 时,可以完全除去其中的杂质离子。
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是_________________ 。

已知:ZnS 可与稀硫酸反应;CuS 不溶于稀硫酸,也不与其发生反应。 请回答下列问题:
(1)可用图装置进行第一次浸出,烧杯中盛放的是

(2)滤液Ⅰ中的 Fe2+最好用
a.氯水 b.双氧水 c.KSCN 溶液 d.K3[Fe(CN)6]溶液
(3)物质 A 是含有 X 元素的氧化物(XO),则 X 是
(4)第二次浸出时的化学方程式为
(5)加 A 调节溶液的 pH 约为
(当溶液中离子浓度小于等于 10-5mol/L 时视为沉淀完全;实验条件下部分物质的溶度积常数为:Ksp[Fe(OH)3]=10-38,Ksp[Fe(OH)2]=10-17,Ksp[Zn(OH)2]=10-17,Ksp[Cu(OH)2]=10-20)
(6)实验最后获得了 5.74gZnSO4•7H2O 晶体(假设实验中没有损耗),但不能由此确定原催化剂中锌元素的质量分数,原因是
您最近一年使用:0次
名校
9 . 铁元素在地壳中含量丰富。下列有关说法不正确的是
| A.不锈钢属于铁合金 | B.用KSCN溶液可检验溶液中的Fe3+ |
| C.铁制品腐蚀过程中铁被还原 | D.浸在有机溶剂溶液中不容易生锈 |
您最近一年使用:0次
2019-07-05更新
|
353次组卷
|
2卷引用:2019年6月广东普通高中学业水平考试B卷化学试题
10 . (NH4)2Fe(SO4)2·6H2O(M=392g/mol)又称摩尔盐,简称FAS,它是浅蓝色绿色晶体,可溶于水,难溶于水乙醇。某小组利用工业废铁屑进行下列实验。请按要求回答下列问题:
Ⅰ. FAS的制取。流程如下:
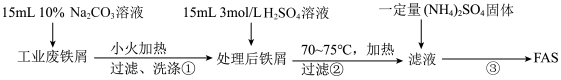
(1)步骤①加热的目的是_________________________ 。
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):______________ 。
Ⅱ.NH4+含量的测定。装置如图所示:
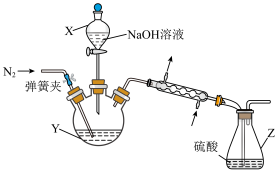
实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称______________ ;N2的电子式为______________ 。
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是__________________ ;NH4+质量百分含量为(用代数式表示)__________________ 。
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)_________ 。滴定中反应的离子方程式为____________________ 。
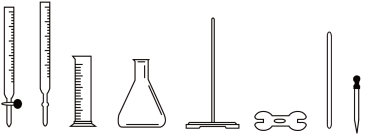
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液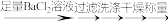 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________ 。
(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是_______________ ;为验证该猜测正确,设计后续实验操作为_________________ ,现象为______________ 。
Ⅰ. FAS的制取。流程如下:

(1)步骤①加热的目的是
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):
Ⅱ.NH4+含量的测定。装置如图所示:

实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)

① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液
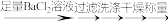 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是
您最近一年使用:0次
2019-04-28更新
|
289次组卷
|
2卷引用:【区级联考】天津市河西区2019届高三下学期二模考试化学试题



