名校
解题方法
1 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
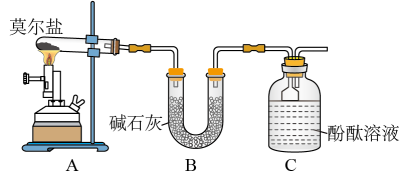
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
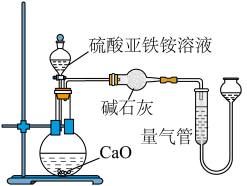
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  |  |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
757次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
2 . 下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。
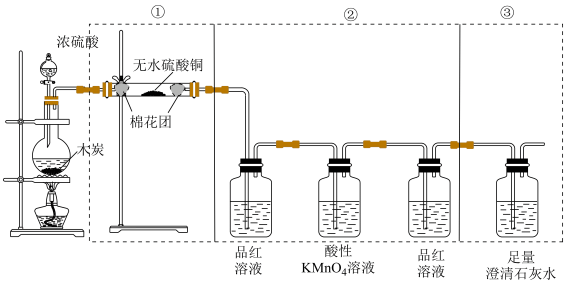
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:___________ 。
(2)②中酸性 溶液的作用是
溶液的作用是___________ ,第二瓶品红溶液的作用是___________ 。
(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是______ ;不能检出的物质是________ 。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________ ;不能检出的物质是___________ 。
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装___________ (填写试剂名称)。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(2)②中酸性
 溶液的作用是
溶液的作用是(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
3 . 设计实验验证Na2SO4与焦炭高温加热后的产物,回答下列问题:
(1)Na2SO4与焦炭反应的实验装置如图所示。
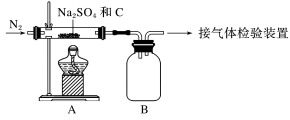
①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是_____ 。
②装置B的作用是_____ 。
(2)该同学认为气体产物中可能含有CO2、CO及SO2,并进行验证,选用上述实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
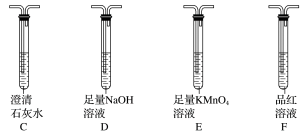
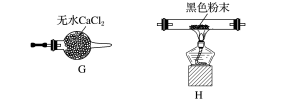
①实验装置连接的合理顺序为A、B、______ ,装置H中黑色粉末是_____ 。
②能证明产物中有CO的现象是______ 。
③若含有SO2,E装置的作用是______ (用化学方程式说明)。
(1)Na2SO4与焦炭反应的实验装置如图所示。

①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是
②装置B的作用是
(2)该同学认为气体产物中可能含有CO2、CO及SO2,并进行验证,选用上述实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。


①实验装置连接的合理顺序为A、B、
②能证明产物中有CO的现象是
③若含有SO2,E装置的作用是
您最近一年使用:0次
名校
4 . 四氯化钛(TiCl4,熔点:-25℃,沸点:136℃)是制备海绵钛和钛白的主要原料, 其实验室制备原理是TiO2(s)+2C(s)+2Cl2(g) TiCl4(g)+2CO(g), 某同学利用如下装置制备
TiCl4(g)+2CO(g), 某同学利用如下装置制备  并验证产物CO。
并验证产物CO。

已知: 遇潮湿空气会发生反应:
遇潮湿空气会发生反应:  。
。
回答下列问题:
(1)写出装置A中制备 的化学反应方程式:
的化学反应方程式: ___________ (注:反应中  被还原为
被还原为  )。
)。
(2)按气流方向从左至右, 上述装置的连接顺序为 A、___________ 、 E。
(3)装置 A 中盛放浓盐酸的仪器名称为___________ , 装置G中盛放的碱石灰的作用是___________ 。
(4)能证明有CO生成的实验现象是___________ 。
(5)产品中 含量测定: 取
含量测定: 取  产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成  溶液, 取
溶液, 取  所配溶液放入锥形瓶中, 滴加几滴
所配溶液放入锥形瓶中, 滴加几滴  的
的  溶液作指示剂, 用
溶液作指示剂, 用  的
的  溶液滴定至终点, 消耗
溶液滴定至终点, 消耗  溶液
溶液  。已知:
。已知:  是一种深红 色固体; 常温下,
是一种深红 色固体; 常温下,  ,
, 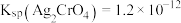 。
。
①安全漏斗中的水在本实验中的作用除加水外, 还有___________ 。
②该沉淀滴定终点的判断方法是___________ 。
③该产品纯度为___________ %(保留一位小数)。
 TiCl4(g)+2CO(g), 某同学利用如下装置制备
TiCl4(g)+2CO(g), 某同学利用如下装置制备  并验证产物CO。
并验证产物CO。
已知:
 遇潮湿空气会发生反应:
遇潮湿空气会发生反应:  。
。回答下列问题:
(1)写出装置A中制备
 的化学反应方程式:
的化学反应方程式:  被还原为
被还原为  )。
)。(2)按气流方向从左至右, 上述装置的连接顺序为 A、
(3)装置 A 中盛放浓盐酸的仪器名称为
(4)能证明有CO生成的实验现象是
(5)产品中
 含量测定: 取
含量测定: 取  产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成
产品于烧瓶中, 向安全漏斗 (如下图所示) 中加入足量蒸馏水后, 立即夹紧弹簧夹, 充分反应后 将安全漏斗及烧瓶中混合物中液体转移到容量瓶中配成  溶液, 取
溶液, 取  所配溶液放入锥形瓶中, 滴加几滴
所配溶液放入锥形瓶中, 滴加几滴  的
的  溶液作指示剂, 用
溶液作指示剂, 用  的
的  溶液滴定至终点, 消耗
溶液滴定至终点, 消耗  溶液
溶液  。已知:
。已知:  是一种深红 色固体; 常温下,
是一种深红 色固体; 常温下,  ,
, 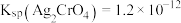 。
。
①安全漏斗中的水在本实验中的作用除加水外, 还有
②该沉淀滴定终点的判断方法是
③该产品纯度为
您最近一年使用:0次
2023-08-24更新
|
313次组卷
|
2卷引用:湖南省长沙市第一中学2023-2024学年高三上学期月考(一)化学试题
名校
5 . SO2虽是大气污染物之一,但也是重要的工业原料。某同学在实验室设计了如下实验,对SO2的部分性质进行了探究。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是_______ (结合有关平衡方程式简要说明)。
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。
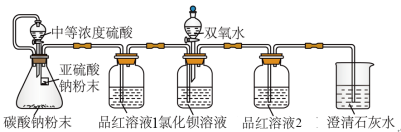
(2)加入碳酸钠粉末的目的是_______ 。
(3)当_______ 时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是_______ 。
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为_______ 。
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若_______ ,说明还原性:SO2>I-,写出该反应的离子方程式:_______ 。
I.二氧化硫的水溶性
(1) SO2易溶于水,溶于水有H2SO3生成。向SO2饱和溶液中加入NaHSO3固体,有气体冒出,原因是
II.验证SO2能否与BaCl2溶液反应
某同学设计了如图装置,且所配制的溶液均使用了无氧蒸馏水,检验SO2在无氧干扰时,是否与氯化钡反应生成沉淀。

(2)加入碳酸钠粉末的目的是
(3)当
(4)装置中选用澄清石灰水而不用氢氧化钠溶液的目的是
III.二氧化硫的还原性
已知SO2具有还原性,可以还原I2,也可以与Na2O2发生反应。
(5)将SO2通入装有过氧化钠的硬质试管中,将带火星的木条放在试管口处。
①若木条不复燃,则说明SO2与Na2O2反应无O2生成,可能发生反应的化学方程式为
②若木条复燃,则说明SO2与Na2O2反应有O2生成,发生反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2。
(6)将SO2通入装有碘水(含淀粉)的洗气瓶中,若
您最近一年使用:0次
2022-12-31更新
|
305次组卷
|
2卷引用:广东省梅州市名校2022-2023学年高三上学期期末考试化学试题
解题方法
6 . 某化学小组制备 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):

(1)仪器a的名称是___________ 。
(2)装置A制取 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的___________ 性,___________ (填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的 ,此操作的目的是
,此操作的目的是___________ 。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为___________ 。
(5)装置D验证了 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:___________ 。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: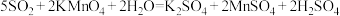 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为___________ 。
 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):
(1)仪器a的名称是
(2)装置A制取
 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的(3)在滴加浓硫酸之前,需先通入一段时间的
 ,此操作的目的是
,此操作的目的是(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为
(5)装置D验证了
 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性
 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: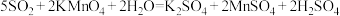 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
2022-07-04更新
|
280次组卷
|
2卷引用:河南省平顶山市2021-2022学年高一下学期期末调研化学试题
7 . 已知浓硫酸和木炭粉在加热条件下可发生化学反应。
(1)反应的化学方程式为___________ 。
(2)试用如图所示装置设计一个实验,验证上述反应所产生的各种产物(该反应有水生成,假定混合气体中的水均来自产物)。
这些装置的连接顺序(按产物气流从左至右的方向)是:_____ (填装置中导管口的编号,下同)接___ ,_____ 接______ ,_____ 接______ 。
(3)实验时可观察到装置①中A瓶中溶液褪色,C瓶中溶液不褪色。B瓶中溶液的作用是______ ;C瓶中溶液的作用是________ 。
(4)装置②中所加固体药品是无水硫酸铜,可验证的产物是__________ 。
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是_________ 。
(1)反应的化学方程式为
(2)试用如图所示装置设计一个实验,验证上述反应所产生的各种产物(该反应有水生成,假定混合气体中的水均来自产物)。
| 编号 | ① | ② | ③ | ④ |
| 装置 | 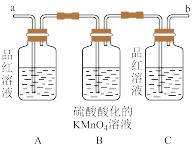 |  |  |  |
(3)实验时可观察到装置①中A瓶中溶液褪色,C瓶中溶液不褪色。B瓶中溶液的作用是
(4)装置②中所加固体药品是无水硫酸铜,可验证的产物是
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是
您最近一年使用:0次
2020-09-15更新
|
888次组卷
|
4卷引用:鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时3 硫酸
名校
解题方法
8 . 摩尔盐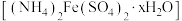 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是___________ 。
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有___________ 。取样品 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为___________ (用含a、b的代数式表示)。
(3)利用摩尔盐分解产生的 ,可制取氯化亚砜
,可制取氯化亚砜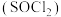 :
: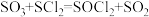 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
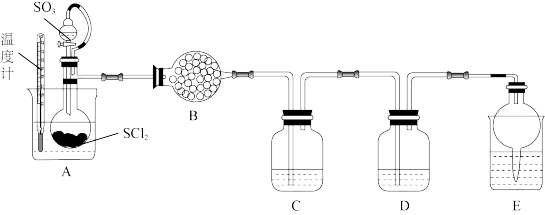
①装置B为无水 ,其作用是
,其作用是___________ 。
②装置C和装置D中的试剂分别是___________ 、___________ (填小写字母)。
a. 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液
(4)利用摩尔盐分解产生的 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
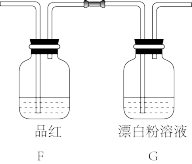
①将少量 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是___________ ,其作用是___________ ,通过___________ (填现象)即可证明亚硫酸的酸性强于次氯酸。
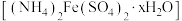 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有
 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为(3)利用摩尔盐分解产生的
 ,可制取氯化亚砜
,可制取氯化亚砜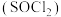 :
: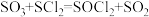 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
①装置B为无水
 ,其作用是
,其作用是②装置C和装置D中的试剂分别是
a.
 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液(4)利用摩尔盐分解产生的
 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量
 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近一年使用:0次
2022-07-15更新
|
303次组卷
|
2卷引用:河南省开封市五县2021-2022学年高二下学期期末考试化学试题
解题方法
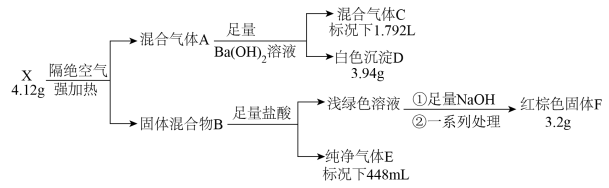
9 . 化合物X由四种元素组成,按如下流程进行实验。混合气体A由气体E和元素种类相同的另两种气体组成,且气体C的平均相对分子质量为8.5。混合物B中有两种固体。
请回答:
(1)组成X的四种元素为_______ ;X的化学式为_______ 。
(2)写出由X到A的化学方程式_______ 。
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因_______ 。
(4)设计实验检验混合气体A中相对分子量较小的两种气体_______ 。

请回答:
(1)组成X的四种元素为
(2)写出由X到A的化学方程式
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因
(4)设计实验检验混合气体A中相对分子量较小的两种气体
您最近一年使用:0次
名校
10 . 某实验小组设计了如图所示装置对焦炭还原二氧化硅的气体产物进行探究。
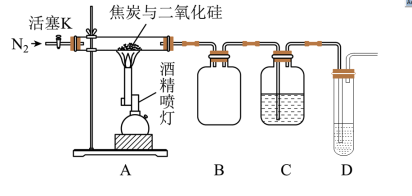
已知: 溶液可用于检验CO,反应的化学方程式为
溶液可用于检验CO,反应的化学方程式为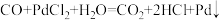 (产生黑色金属钯,使溶液变浑浊)。
(产生黑色金属钯,使溶液变浑浊)。
(1)实验时要长时间通入 ,其目的是
,其目的是__________________________________________________ 。
(2)装置B的作用是__________________________________________________ 。
(3)装置C、D中所盛试剂分别为_____________ 、_____________ ,若装置C,D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为__________________________ 。
(4)该装置的缺点是__________________________________________________ 。

已知:
 溶液可用于检验CO,反应的化学方程式为
溶液可用于检验CO,反应的化学方程式为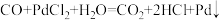 (产生黑色金属钯,使溶液变浑浊)。
(产生黑色金属钯,使溶液变浑浊)。(1)实验时要长时间通入
 ,其目的是
,其目的是(2)装置B的作用是
(3)装置C、D中所盛试剂分别为
(4)该装置的缺点是
您最近一年使用:0次
2020-10-03更新
|
856次组卷
|
7卷引用:河北省邢台市第一中学2017-2018学年高一下学期开学考试化学试题
河北省邢台市第一中学2017-2018学年高一下学期开学考试化学试题人教版(2019)必修第二册第五章第三节 课时2必修第二册RJ第5章第三节 无机非金属材料 课时2 新型无机非金属材料云南省曲靖市罗平县第二中学2020-2021学年高一下学期6月月考化学试题(已下线)第08讲 硅酸盐材料 硅(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)安徽省合肥市肥东县综合高中2021-2022学年高一下学期期中考试化学试题江苏省无锡市锡山高级中学2022-2023学年高一下学期期中考试化学试卷



