1 . 草酸亚铁晶体(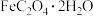 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。

(1)按照气流从左到右的方向,上述装置的接口顺序为A→_______ →尾气处理装置(仪器可重复使用)。
(2)实验证明了气体产物中含有 ,依据的实验现象为
,依据的实验现象为_______ 。
(3)实验证明了气体产物中含有CO,依据的实验现象为_______ 。
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为_______ 。
(5)工业制得的草酸亚铁晶体中常含有 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品溶于稀 中,配成250 mL溶液;
中,配成250 mL溶液;
步骤2:取上述溶液25.00 mL,用
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀 ,再用
,再用
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。
①步骤2中滴定终点的现象为_______ 。
②该样品中草酸亚铁晶体的质量分数的表达式为_______ 。
③若步骤1配制溶液时部分 被氧化变质,则测定结果将
被氧化变质,则测定结果将_______ (填“偏高”“偏低”或“不变”)。
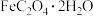 ,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
,M=180 g/mol )呈淡黄色。某学习小组采用如图装置对其进行了一系列探究其分解产物的实验。
(1)按照气流从左到右的方向,上述装置的接口顺序为A→
(2)实验证明了气体产物中含有
 ,依据的实验现象为
,依据的实验现象为(3)实验证明了气体产物中含有CO,依据的实验现象为
(4)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为
(5)工业制得的草酸亚铁晶体中常含有
 杂质,测定其纯度的步骤如下:
杂质,测定其纯度的步骤如下:步骤1:称取m g草酸亚铁晶体样品溶于稀
 中,配成250 mL溶液;
中,配成250 mL溶液;步骤2:取上述溶液25.00 mL,用
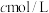
 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液 ;
;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀
 ,再用
,再用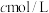
 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 。
。①步骤2中滴定终点的现象为
②该样品中草酸亚铁晶体的质量分数的表达式为
③若步骤1配制溶液时部分
 被氧化变质,则测定结果将
被氧化变质,则测定结果将
您最近一年使用:0次
2022-12-16更新
|
191次组卷
|
2卷引用:辽宁省大连市滨城联盟2022-2023学年高三上学期期中(‖)考试化学试题
名校
解题方法
2 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |
| 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
186次组卷
|
4卷引用:北京市石景山区2022-2023学年高二下学期期末考试化学试题
北京市石景山区2022-2023学年高二下学期期末考试化学试题北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题名校期末好题汇编-烃的衍生物(非选择题)(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)
名校
3 . “7•20”特大洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效措施之一。“84”消毒液、漂白粉和ClO2等都是有效的消杀试剂。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理____ ,标况下56L氯气完全被吸收,需要____ L1mol/L的NaOH溶液。
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为_____ 。
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论____ (填“同意”或“不同意”),若不同意,你认为的结论是____ (若同意,此空不用填)
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是_____ (从①②③中选填)。
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为_____ 。ClO2还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式_____ 。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:Ca(ClO)2溶液呈碱性;Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;Ca(ClO)2+2HCl(稀)=CaCl2+2HClO
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,你是否同意他的结论
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是
(4)目前普遍使用ClO2代替Cl2及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。其摩尔质量为
您最近一年使用:0次
名校
4 . 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、酸性KMnO4溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式_______________________________________ 。
(2)试设计实验证明溶液X中含过氧化氢____________________________________ 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______ H2O2+______ Fe2++_____ OH-===______ Fe(OH)3↓,该反应中H2O2表现了_______ (填“氧化”或“还原”)性。
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了______ (填“氧化”或“还原”)性。该反应的离子方程式为____________________ 。
(1)写出Na2O2与水反应的化学方程式
(2)试设计实验证明溶液X中含过氧化氢
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了
您最近一年使用:0次
名校
5 . 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】“菠菜豆腐不能同食”的原因可能是____________ 。
【探究一】菠菜中部分成分分析

(1)步骤③中判断加入的CaCl2溶液已足量的方法是___________ 。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式________________ 。沉淀A、B的质量关系为:m(A)_________ m(B)(填“>”、“<”或“=”)。
(3)白色沉淀B的化学式为_________ ,由此可见菠菜豆腐不能同食。以下饮食观点正确的是__________ (填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4 ;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
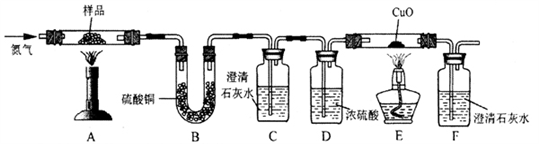
(4)①反应开始前通入氮气的目的是___________ ,装置C的作用是_______________ 。
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有__________________ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议_____________ 。
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为_______ 。
②残留固体为CaC2O4时的温度范围__________ 。
③写出固体质量由12.8g变为10.0g时的化学方程式________________ 。
【查阅资料】①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【提出猜想】“菠菜豆腐不能同食”的原因可能是
【探究一】菠菜中部分成分分析

(1)步骤③中判断加入的CaCl2溶液已足量的方法是
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAc表示,写出步骤④的化学反应方程式
(3)白色沉淀B的化学式为
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
(提示:CaC2O4·xH2O受热会失去结晶水成为CaC2O4 ;白色硫酸铜粉末遇水会变蓝。)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)

(4)①反应开始前通入氮气的目的是
②装置B中硫酸铜粉末变蓝,C、F中澄清石灰水均变浑浊,E中CuO变红,说明产物有
③对上述装置从环保角度提一个改进建议
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,
获得相关数据,绘制成固体质量—分解温度的关系如图。

①800℃以上时,固体成分的化学式为
②残留固体为CaC2O4时的温度范围
③写出固体质量由12.8g变为10.0g时的化学方程式
您最近一年使用:0次
名校
6 . 已知,在木炭还原氧化铜的实验中发生的主要反应是C+2CuO 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实
验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到_______________ ,说明猜想正确。
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是_______________ 。
(2)装置C的作用是__________________ 。
(3)写出装置D中反应的化学方程式___________________________ 。
(4)下列为加热装置前所涉及的部分操作,正确的顺序是_________ (填序号)。
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为__________ 。
指出该装置的不足之处,说明不足的理由并给出改进方案__________________ 。
 2Cu+CO2↑。某化学实验小组对该实
2Cu+CO2↑。某化学实验小组对该实验产物(假设已完全反应)进行了如下探究:
探究一:检验产物的成分
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体,那么该暗红色固体物质是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体,可以和硫酸反应:Cu2O+H2SO4═CuSO4+Cu+H2O。
【猜想假设】暗红色固体除铜外还可能含有Cu2O。
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到
探究二:测定产物中Cu2O的含量

【查阅资料】草酸在浓硫酸的作用下会分解为CO和CO2
【设计实验】称取固体样品6.0g,置于上右图装置D中进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置E的质量达到实验目的。
(1)证明草酸的分解产物中有CO2存在的是
(2)装置C的作用是
(3)写出装置D中反应的化学方程式
(4)下列为加热装置前所涉及的部分操作,正确的顺序是
①检查装置的气密性 ②关闭K2,打开K1,使装置A中的反应先进行一段时间
③连接仪器 ④关闭K1,打开K2
(5)若装置E在反应前后的质量分别为30.1g和31.2g,则该固体样品中Cu2O的质量分数为
指出该装置的不足之处,说明不足的理由并给出改进方案
您最近一年使用:0次